(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
| CaS04 |
Mg2(OH) 2C03 |
CaC03 |
BaS04 |
BaC03 |
| 2.6x 1 0-2 |
2.5×10-4 |
7.8x 10-4 |
2.4x 10-4 |
1.7 x 1 0-3 |
①检测Fe3+是否除尽的方法是__________________________________________________________。
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因______________________________。
③除去Mg2+的离子方程式是____________________________________________。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测__________________________(填离子符号)。
(2)第二次精制要除去微量的Iˉ、IO3ˉ、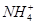 、Ca2+、Mg2+,流程示意如下:
、Ca2+、Mg2+,流程示意如下: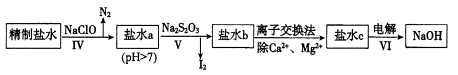
①过程IV除去的离子是____________________________________。
②盐水b中含有SO42-。Na2S203将IO3ˉ还原为I2的离子方程式是 ______________________。
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:_______________________.
(18分)(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体。已知: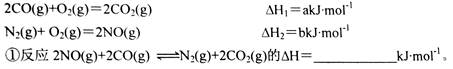
②可以利用反应: (n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
a.NH3b.CO2c.SO2d.CH3CH2OH
当反应中转移1.2mol电子时,消耗NO2____________L(标准状况)。
③用NaOH溶液吸收工业尾气中的SO2最终制得石膏(CaSO4.2H2O)。为节约资源减少排放实现物质的循环利用,生产过程中还需要加入的固体物质是____________(填化学式)。
(2)工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示。则a极为___________极,该极的电极反应式________________________________________
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于_______法。
(16分)天然气在生产、生活中具有广泛的应用。
(1)CO2(g)+4H2(g) CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
(2)另一合成CH4的原理:CO(g)+3H2(g) CH4(g)+H2O(g)。某温度时将0.1molCO和0.3mol H2充入10L的密闭容器内,l0min时达平衡。测得10min内v(CO)= 0.0009mol·L-1·min-1,则H2的平衡转化率为______,该温度下反应的平衡常数为___________mol-2·L2。
CH4(g)+H2O(g)。某温度时将0.1molCO和0.3mol H2充入10L的密闭容器内,l0min时达平衡。测得10min内v(CO)= 0.0009mol·L-1·min-1,则H2的平衡转化率为______,该温度下反应的平衡常数为___________mol-2·L2。
(3)某实验小组依据甲烷燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,乙池中盛有1L lmo1·L-1CuSO4溶液。a电极通入的气体为CH4,其电极反应式是______,b电极的现象为______。一段时间内乙池中溶液的pH由2变为1,则在这段时间内转移电子的物质的量为________mol。
某汽车安全气囊的产气药剂主要含有
、
、
、
等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)
是气体发生剂,受热分解产生
和
,
的电子式为。
(2)
是主氧化剂,与
反应生成的还原产物为(已知该反应为置换反应).
(3)
是助氧化剂,反应过程中与
作用生成
和
。
含有化学键的类型为,
的原子结构示意图为。
(4)
是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为。
(5)100
上述产气药剂产生的气体通过碱石灰后得到
33.6
(标准状况)。
①用碱石灰除去的物质为;
②该产气药剂中
的质量分数为。
物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述。在基态原子中,核外存在对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是。
(3)
分子中,共价键的类型有,
原子的杂化轨道类型是,写出两个与
具有相同空间构型和键合形式的分子或离子。
(4)
能与金属
形成
,该化合物的熔点为253
,沸点为376
,其固体属于晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个
原子连接个六元环,每个六元环占有个C原子。
②在金刚石晶体中,
原子所连接的最小环也为六元环,每个
原子连接个六元环,六元环中最多有个
原子在同一平面。
、
、
、
为原子序数依次增大的四种元索,
和
具有相同的电子构型;
、
为同周期元索,
核外电子总数是最外层电子数的3倍;
元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是(填元素符号),其中
原子的核外电子排布式为。
(2)单质
有两种同素异形体,其中沸点高的是(填分子式),原因是;
和
的氢化物所属的晶体类型分别为和。
(3)
和
反应可生成组成比为1:3的化合物
,
的立体构型为,中心原子的杂化轨道类型为。
(4)化合物
的立体构型为,中心原子的价层电子对数为,单质D与湿润的
反应可制备
,其化学方程式为。
(5)
和
能够形成化合物
,其晶胞结构如图所示,晶胞参数,
=0.566
,
的化学式为:晶胞中
原子的配位数为;列式计算晶体F的密度(
)。