甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)工业上合成甲醇一般采用下列反应:CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。

压强:P1 P2(填“>”、“=”或“<”)。
(3)在容积固定的密闭容器中发生CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
| 浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH) |
| 0 |
0.8 |
1.6 |
0 |
| 2 |
0.6 |
1.2 |
0.2 |
| 4 |
0.3 |
0.6 |
0.5 |
| 6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。

①写出阳极电极反应式_____________________________________________________________;
②写出除去甲醇的离子方程式_______________________________________________________。
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下: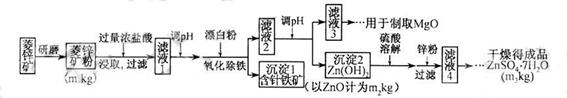
(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Go ethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
ethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为______。
2”的pH时,理论上可选用的最大区间为______。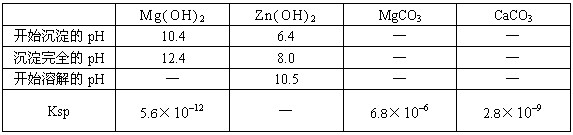
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。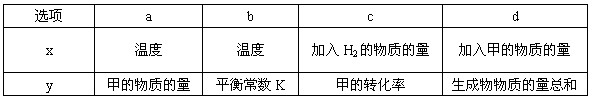
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k J。该反应的热化学方程式为________。
J。该反应的热化学方程式为________。
向盛有
溶液的试管中加入少许
后滴加氯水,
层 变成紫色。如果继续向试管中滴加氯水,振荡,
层会逐渐变浅,最后变成无色。
变成紫色。如果继续向试管中滴加氯水,振荡,
层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平
 层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
2)整个过程中的还原剂是。
3)把
换成
,则
层变为色:继续滴加氯水,
层的颜色没有变化。
、
、
氧化性由强到弱的顺序是。
4)加碘盐中含碘量为20
~50
/
。制取加碘盐(含
的食盐)1000
,若庄
与
反应制
,至少需要消耗
(标准状况,保留2位小数)。
接触法制硫酸工艺中,其主反应在
并有催化剂存在下进行:
1)该反应所用的催化剂是(填写化合物名称),该反应 时的平衡常数 时的平衡常数(填"大于"、"小于"或"等于").
2)该热化学反应方程式的意义是.
3)达到化学平衡状态的是
a.
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入
和
,半分钟后达到平衡,测得容器中含
,则
:若继续通入
和
,则平衡移动(填"向正反应方向"、"向逆反应方向"或"不"),再次达到平衡后,mol<
<mol。
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(
)等化合物。
1)三硅酸镁的氧化物形式为,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为。
2)铝元素的原子核外共有种不同运动状态的电子、种不同能级的电子。
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径(填"大"或"小"),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
4)
、
和
都可以制耐火材料, 其原因是。
a.
、
和
都不溶于水
b.
、
和
都是白色固体 c.
、
和
都是氧化物
c.
、
和
都是氧化物
d.
,
和
都有很高的熔点