下列实验操作、现象和结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
用玻璃棒蘸取氯水点到蓝色石蕊试纸上 |
试纸先变红后褪色 |
氯水中含有H+和HClO |
| B |
向装有Fe(NO3)2溶液的试管中加入稀H2SO4, |
在管口观察到红棕色气体 |
NO3-被还原为NO2 |
| C |
向鸡蛋清溶液中,分别加入饱和(NH4)2SO4溶液和BaCl2溶液 |
均有沉淀产生 |
两者均发生了盐析 |
| D |
水蒸气与灼热铁粉反应后的残余固体中加入足量稀H2SO4,再加入KSCN溶液 |
溶液不显红色 |
过量的铁粉与Fe3+完全反应生成Fe2+ |
已知:H2O(g)==H2O(l)△H1=-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)==C2H5OH(l)△H2=-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g)△H3=-Q3kJ·mol-1(Q3>0)
依据盖斯定律,若使23g液态乙醇完全燃烧并恢复至室温,则放出的热量为(单位:kJ)
| A.Q1+Q2+Q3 | B.0.5(Q1+Q2+Q3) | C.0.5Q1-1.5Q2+0.5Q3 | D.1.5Q1-0.5Q2+0.5Q3 |
一些烷烃的燃烧热如下表:下列表达正确的是
| 烷烃 |
燃烧热/kJ·mol-1 |
烷烃 |
燃烧热/kJ·mol-1 |
| 甲烷 |
891.0 |
正丁烷 |
2878.0 |
| 乙烷 |
1560.8 |
异丁烷 |
2869.6 |
| 丙烷 |
2221.5 |
异戊烷 |
3531.3 |
A.正戊烷的燃烧热小于3531.3 kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)==4CO2(g)+6H2O(g)△H=-1560.8 kJ·mol-1
D.相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
| 化学式 |
电离常数 |
| HClO |
K=3×10-8 |
| H2CO3 |
K1=4.3×10-7 |
| K2=5.6×10-11 |
 A.c(HCO3-)>c(ClO-)>c(OH-)
A.c(HCO3-)>c(ClO-)>c(OH-) B.c(ClO-)>c(HCO3-)>c(H+)
B.c(ClO-)>c(HCO3-)>c(H+) C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3-)  D.c(Na+)+c(H++H)=c(HCO3-)+c(ClO-)+c(OH-)
D.c(Na+)+c(H++H)=c(HCO3-)+c(ClO-)+c(OH-)
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
根据下图,可判断出下列离子方程式中错误的是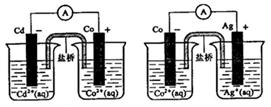
| A.2Ag(s)+Cd2+(aq)==2Ag+( aq) +Cd(s) | B.Cd(s)+Co2+(aq)==Cd2+( aq) +Co(s) |
| C.2Ag+(aq)+Cd(s)="=2Ag(s" ) +Cd2+(aq) | D.2Ag+(aq)+Co(s)="=2Ag(s" ) +Co2+(aq) |