菠菜营养丰富,在营养价值上是一种高效的补铁剂。但因草酸含量高,因而吃起来有涩味。某学校化学兴趣小组的同学拟通过实验探究以下问题:
①菠菜是否含有丰富的铁;
②菠菜中草酸及草酸盐的含量(以C2O42-计);
通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,其中草酸钙不溶于水。
他们设计的实验步骤如下:
Ⅰ.取菠菜样品,按如下步骤进行实验,观察实验现象。
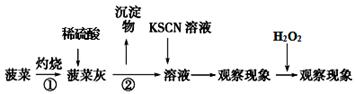
Ⅱ.另取一份菠菜样品研磨成汁后,在少量开水中煮沸2~3 min,冷却后过滤得滤液。向滤液中加入足量Ca(OH)2溶液,然后再加入足量试剂X,观察现象。并过滤得CaC2O4固体。
Ⅲ.用稀HCl溶解CaC2O4,并加水配制成100mL溶液.每次准确移取25.00mL该溶液,用0.0100mol•L-1KMnO4标准溶液滴定,平均消耗标准溶液VmL。(不考虑Cl-被KMnO4氧化。)
请回答以下问题:
(1)操作①中使用的仪器除三脚架、泥三角、酒精灯、玻璃棒外,还需要的硅酸盐质仪器 ,操作②的名称是 。
(2)通过资料分析,菠菜中的Fe是+2价还是+3价? 。
步骤I中 (填现象)可以证明该结论?
(3)通过步骤Ⅱ可以确定菠菜中含有草酸类物质。由于滤液中含有CO32-,故需加入试剂X排除CO32-的干扰。
则X是 (写化学式),加入试剂X后可观察到沉淀部分溶解。
(4)步骤Ⅲ中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有 ,该步骤中滴定操作的终点如何判断________________;所涉及的离子反应方程式 。
(5)若样品的质量为W g,则菠菜中草酸及草酸盐(以C2O42-计)的质量分数为___ __。
(12分)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110 ℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO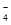 被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010 mol·L-1KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO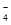 被还原成Mn2+。
被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010 mol·L-1 KMnO4溶液19.98 mL。
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是称量、______、转移、洗涤并转移、________、摇匀。
②步骤二中加入锌粉的目的是________________。
③写出步骤三中发生反应的离子方程式:____________。
④实验测得该晶体中铁的质量分数为________。
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110 ℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误:________;__________。
(14分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
探究一
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用(选填序号)
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2
的体积分数为。
探究二
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含少量的H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。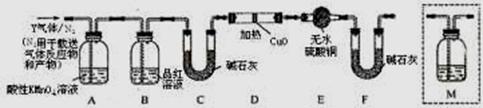
(3)装置B中试剂的作用是。
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是。
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质)的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为;
在加高锰酸钾溶液前,若pH较低,对除杂的影响是;
(2) 反应③的反应类型为,过滤得到的滤渣中,除了过量的锌外还有;
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干操后的滤饼11.2g,煅烧后可得到产品8.1 g,则x等于 。
通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:
H2C2O4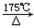 H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置可以重复使用)。酒精喷灯可作高温热源。
H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置可以重复使用)。酒精喷灯可作高温热源。
请回答下列问题:
(1)检验装置A气密性良好的方法是
(2)从左到右连接装置的顺序是:A→;
(3) 证明CO存在的实验现象是;
(4)本实验尾气处理的方法是。
食盐是日常生活的必需品,也是重要的化工原料。
粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳。实验室提纯NaCl的流程如下: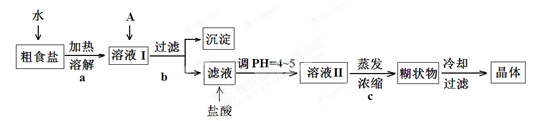
(1) 欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的多种试剂,按滴加顺序依次为i NaOH iiii。(填化学式)
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i:;加入试剂iii:。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为。(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如下:
欲用上浓盐酸配制实验所需浓度的稀盐酸480ml,
①配制需要的玻璃仪器有(填仪器名称)。
②需量取的浓盐酸的体积为:。