下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是
| 选项 |
离子组 |
加入试剂(溶液) |
加入试剂后发生反应的离子方程式 |
| A |
SO42-、Fe2+、NO3-、K+ |
K3[Fe(CN)6] |
3Fe2++2[Fe(CN)6]2-=Fe3[Fe(CN)6]2↓ |
| B |
Na+、Fe3+、I-、ClO- |
HCl |
ClO-+H+=HClO |
| C |
Ba2+、Al3+、Cl-、H+ |
少量NaOH |
Al3++3OH-=Al(OH)3↓ |
| D |
S2O32+、Na+、Cl-、SO32-、K+ |
过量硫酸 |
2S2O32-+2H+=SO42-+3S↓+H2O |
已知:①H2O(g)=H2O(l) △H1=-Q1 kJ·mol—1;
②C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ·mol—1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ·mol—1
若使23g酒精液体完全燃烧,生成稳定的氧化物,最后恢复到室温,则放出的热量是多少kJ()
| A.Q1+ Q2+Q3 | B.0.5(Q1+Q2+Q3) |
| C.0.5 Q1-1.5 Q2+0.5Q3 | D.1.5Q1-0.5Q2+0.5Q3 |
利用生活中常见的材料可以进行很多科学实验,甚至
制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制
作的可用于驱动玩具的电池的示意图。上述电池工作时,有关说法
正确的是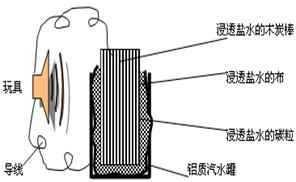
| A.铝罐将逐渐被腐蚀 |
| B.碳粒和炭棒上发生的反应为:O2+4e-=2O2- |
| C.炭棒应与玩具电机的负极相连 |
| D.该电池工作一段时间后炭棒和炭粒的质量会减轻 |
用Pt电极电解含有各0.1 mol Cu2+和X3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系见图所示。则离子的氧化能力由大到小排列正确的是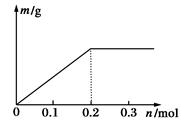
| A.Cu2+>X3+>H+ | B.H+>X3+>Cu2+ |
| C.X3+>H+>Cu2+ | D.Cu2+>H+>X3+ |
炽热的炉膛内有反应:C(s)+O2(g)=CO2(g),△H=-392kJ·mol—1 往炉膛内通入水蒸汽时,有如下反应:C(s)+H2O(g)=CO(g)+H2(g),△H=+131 kJ·mol—1 CO(g) + 1/2O2(g)= CO2(g),ΔH="-282" kJ·mol—1 H2(g)+1/2O2(g)=H2O(g),△H=-241kJ·mol—1,由以上反应推断往炽热的炉膛内通入水蒸汽时()
| A.既能使炉火更旺,又能节省燃料 |
| B.虽不能使炉火更旺,但可以节省燃料 |
| C.不能节省燃料,但能使炉火瞬间更旺 |
| D.既不能使炉火更旺,又不能节省燃料 |
目前人们正研究开发一种高能电池——钠硫电池,它以熔融的钠、硫为两极,以Na+导电的 陶瓷作固体电解质,反应为
陶瓷作固体电解质,反应为 ,以下说法正确的是
,以下说法正确的是
A.放电时,硫作负极,电极反应式为:  +2e-=Sx2- +2e-=Sx2- |
| B.放电时,电池中消耗4.6g Na,反应中转移1.204×1023个电子 |
| C.该反应一定是一个自发进行的吸热反应。 |
| D.放电时,电子从钠极经外电路流向到硫极,再从硫极经内电路流向钠 |