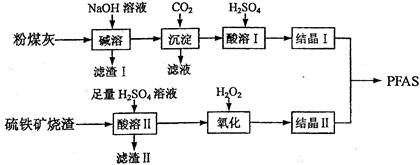
【化学—选修2化学与技术】聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:
(1)水是生命之源,水质优劣直接影响人体健康. 天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是 。水的净化与软化的区别是 。
(2)“碱溶”时,发生反应的化学方程式为 。“滤渣Ⅰ”成分是_________。
(3)“酸溶Ⅱ”时,可以产生Fe2+的反应的离子方程式为 。
(4)“氧化”时应控制在比较低的温度下进行,原因是 。
(5)“氧化”时若用ClO2代替,发生反应的离子方程式是 。
(8分)反应mA+nB pC在某温度下达到平衡。
pC在某温度下达到平衡。
(1)若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________。
(2)若A为液体,C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向________(填“正反应”或“逆反应”)方向移动。
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为________态。
(4)若升高温度,A物质的转化率增大,则该反应为________(填“吸热”或“放热”)反应。
(10分) 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。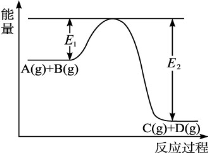
(1)该反应是____________(填“吸热”或“放热”)反应。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”或“不变”),原因是_____。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”“减小”或“不变”)。
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

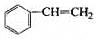

(甲) (乙) (丙) (丁)
填写下列空白:
(1)下列试剂能与甲反应而褪色的是___________(填标号)
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):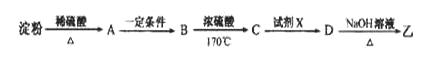
A的分子式是___________,试剂X可以是___________。
(4)已知:
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是________。
镇痉药物C,化合物N以及高分子树脂( )的合成路线如下:
)的合成路线如下:
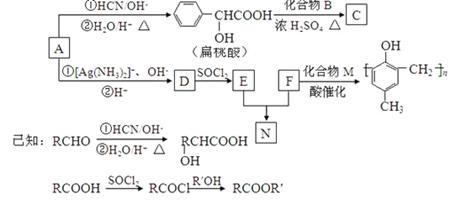
(1)A的含氧官能团的名称是________。
(2)A在催化剂作用可与H2反应生成B,该反应的反应类型是________。
(3)酯类化合物C的分子式是C15H14O3,其结构简式是________。
(4)A发生银镜反应的化学方程式是________________。
(5)扁桃酸(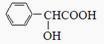 )有多种同分异构体,其中满足下述条件的同分异构体有________种:①能水解②能发生银镜反应③遇FeCl3溶液显紫色。
)有多种同分异构体,其中满足下述条件的同分异构体有________种:①能水解②能发生银镜反应③遇FeCl3溶液显紫色。
写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式______________。
(6)N在NaOH溶液中发生水解反应的化学方程式是________。
某有机物A由C、H、O三种元素组成,90克A完全燃烧可生成132克CO2和54克H2O。试求:
①该有机物的最简式________。
②若符合该最简式的A物质可能不止一种,则它们之间的关系________(填序号)
A.一定互为同系物B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
③若A的相对分子质量为180,每个碳原子上最多只有一个官能团,能发生银镜反应,也能发生酯化反应,且所有碳原子在同一链上,则A的结构简式为________。