将4.0g Cu–Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应。过滤、称量滤液的质量。相关实验数据如下:
| 反应前物质的质量 / g |
反应后物质的质量 / g |
|
| Cu–Zn合金 |
稀硫酸 |
固体和液体的总质量 |
| 4.0 |
10 |
13.96 |
若不考虑该合金中除Cu、Zn以外的其他成分,请计算原Cu–Zn合金中Zn的质量。写出必要的计算过程。(可能用到的相对原子质量: H-1 O-16 S-32 Cu-63.5 Zn-65)
化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸(密度为1.1g/mL)来测定其溶质的质量分数。甲组同学的实验如图1所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,溶液pH的变化如图2所示.请回答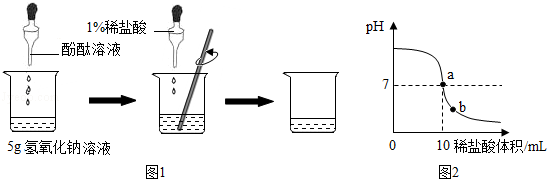
(1)a点溶液中大量存在的离子有__________
(2)b点溶液中的溶质有__________________
(3)计算氢氧化钠溶液中溶质的质量分数。(保留一位小数)
酸和碱发生中和反应,它在日常生活和农业生产中有着广泛的应用。小强同学在做中和反应实验时,向盛有40克10%氢氧化钠溶液的烧杯中逐滴加入稀硫酸,滴加过程如图所示,求所加稀硫酸的溶质质量分数。
鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应)。化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验:
反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应。请回答下列问题(可以选下列任意两个问题回答,并写出计算过程):
(1)反应①产生的CO2的质量为___________________;
(2)该鸡蛋壳中碳酸钙的质量分数为________________;
(3)所加氢氧化钙的质量为__________________;
(4)溶液b中溶质的质量分数为_________________;
计算过程:
某造纸厂的废水中含一定量的碳酸钠和硫酸钠,为回收再利用,实验小组做如下实验:取废水100 g,向其中加入一定质量分数的稀硫酸50 g,恰好完全反应,所得溶液的质量是147.8 g。
(1)反应后溶液中的溶质是____________。
(2)生成二氧化碳的质量是____________g。
(3)若将溶液蒸干,得到7.8 g固体。计算原废水中碳酸钠和硫酸钠的质量比。
据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜。该反应的化学方 程式为:2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O。用980g稀硫酸恰好能与80g含铜80%的废料完全反应(假设杂质不参加反应,也不溶于水)。
2CuSO4 + 2H2O。用980g稀硫酸恰好能与80g含铜80%的废料完全反应(假设杂质不参加反应,也不溶于水)。
求:(1)反应后所得溶液中硫酸铜的质量。
(2)若使反应后溶液中溶质的质量分数变为10%,需要加入水的质量。