(1)写出表示含有8个质子、10个中子、10个电子的离子的符号 。(写成ZAXn-的形式)
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行 族。
下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
[来] |
||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是,氧化性最强的单质是,还原性最强的单质是;
(2)最高价氧化物的水化物碱性最强的是,酸性最强的是,
呈两性的是;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的;
(4)在B、C、D、E、F、G、H中,原子半径最大的是.
A、B、C、D、E、F为六种20号以前的元素,其核电荷数依次增大,A、B同周期,两者相隔一元素;B、D同主族相邻,A、B、D三种元素的核电荷数之为和30。C、E能形成CE型离子化合物。F的次外层有8个电子,已知它的最外层不止一个电子。回答:
(1)写出各元素名称:A B C D E F
(2)A、D、E最高价氧化物的水化物酸性由强到弱的顺序(填化学式):
(3)比较A、B气态氢化物的稳定性(填化学式):
(4)比较D、E氢化物的还原性(填化学式):
A元素原子M电子层上有6个电子。B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子。
(1)B元素的原子结构示意图为___________
(2)A、B两元素形成的化合物的名称是________
(3)用电子式表示B2A的形成过程
写出下列物质的电子式:
KCl K2O
N2 CS2
CS2
H2S分子的形成过程:_________________________________.
MgCl2分子的形成过程:_________________________________.
由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种均为带一个单位正电荷的阳离子或一个单位负电荷的阴离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A++B-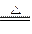 C+D, B-+E+=2
C+D, B-+E+=2 D;
D;
②通常情 况下,C是一种无色刺激性气味的气体,且可使湿润的红色石
况下,C是一种无色刺激性气味的气体,且可使湿润的红色石 蕊试纸变蓝;
蕊试纸变蓝;
③向含F离子的溶液中加入C的水溶液,可生成白色沉淀W,C溶液过量沉淀也不消失。再加入含大量B离子或大量E离子的溶液时,沉淀W在其中一种情况下溶解,另一种情况下不溶解。
请回答下列问题:
(1)微粒A的名称及化学式分别为、。
(2)C的水溶液中存在的分子总数至少有种。
(3)写出微粒F与过量C的水溶液反应的离子方程式:。
(4)向含有0.1mol F离子的50mL溶液中,加入含1.5mol/L B离子的200mL强碱溶液,结果有白色沉淀产生,再向该混合物中加入含1mol/L E离子的强酸溶液,若要使沉淀恰好溶解,则最后加入的溶液的体积至少为mL。