一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
| B.反应开始时10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始时10s,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直接电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误的是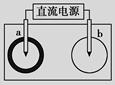
| A.b电极是阴极 |
| B.a电极与电源的正极相连接 |
| C.电解过程中,水是氧化剂 |
| D.b电极附近溶液的pH变小 |
有关如图装置的叙述不正确的是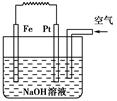
| A.这是电解NaOH溶液的装置 |
| B.该装置中Pt为正极,电极反应为O2+2H2O+4e-==4OH- |
| C.该装置中Fe为负极,电极反应为Fe+2OH-===Fe(OH)2+2e- |
| D.这是一个原电池装置 |
下列关于金属的腐蚀说法正确的是
| A.一般来说,金属发生化学腐蚀的速率比电化学腐蚀速率要快 |
| B.保护地下钢管不受腐蚀,可使它连接直流电源的负极 |
| C.钢铁发生析氢腐蚀时,正极的电极反应式为:2H2O+O2+4e-=4OH- |
| D.轮船底部放一块锌块,所采用的防腐方法为牺牲阴极的阳极保护法 |
化学用语是学习化学的重要工具,下列化学用语中,正确的是
A.NH4+的水解反应离子方程式:NH4+ + H2O NH3·H2O + H+ NH3·H2O + H+ |
| B.在AgCl悬浊液中加入KI溶液充分振荡:Ag+ + I- = AgI↓ |
| C.镀铜时,阳极的电极反应式为: Cu2++2e- ="=" Cu |
| D.某反应⊿H<0,则该反应在任意条件下均可自发进行。 |
已知如下物质的溶度积常数FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24.下列说法正确的是
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol·L-1 |
| C.因为H2SO4是强酸,所以Cu2++H2S===CuS↓+2H+不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |