下列说法错误的是
| A.升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 |
| B.决定化学反应速率的主要因素是参加反应的物质的性质 |
| C.对于有气体参加的反应,增大压强,反应速率加快 |
| D.催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
下列反应的离子方程式中,书写正确的是
A.实验室用大理石跟稀盐酸制取二氧化碳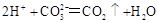 |
| B.氯气与水反应 Cl2 + H2O = 2H+ + Cl- + ClO- |
C.氧化铝跟氢氧化钠溶液反应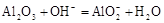 |
D.金属钠跟水反应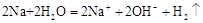 |
Na2CO3固体中可能含有杂质K2CO3、NaHCO3、NaCl中的一种或几种,取10.6g样品,加入足量的稀盐酸产生气体4.8g,下列分析正确的是
| A.一定含有NaHCO3 | B.一定含有K2CO3 |
| C.一定不含NaCl | D.一定含有NaCl |
下列变化不能通过一步反应直接完成的是
| A.Al→AlO2- | B.CO2 →HCO3- |
| C.SiO2 → H2SiO3 | D.SO2 → H2SO3 |
下列各组离子能够大量共存且溶液呈无色的是
| A.K+、Na+、Cl-、CO32- | B.Mg2+、Al3+、OH-、SO42- |
| C.H+、Ag+、Cl-、SO42- | D.Fe2+、H+、Na+、NO3- |
把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等,则已反应的Fe3+和未反应Fe3+的的物质的量之比为
| A.1:1 | B.1:2 | C.2:3 | D.3:2 |