在t℃下,某反应达到平衡,平衡常数K=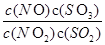 。恒容时,温度升高,NO浓度减小。下列说法正确的是
。恒容时,温度升高,NO浓度减小。下列说法正确的是
| A.升高温度,逆反应速率减小 |
B.该反应化学方程式为:NO+SO3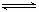 NO2+SO2 NO2+SO2 |
| C.该反应的焓变为正值 |
| D.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是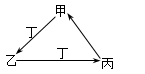
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为Fe,则丁可能是Cl2 |
| C.若甲为AlCl3,则丁可能是NH3 |
| D.若甲为NaHCO3,则丁可能是HCl |
下列实验装置或操作能达到实验目的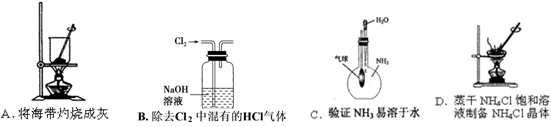
下列有关物质性质、应用的说法正确的是
| A.小苏打可与酸反应,可用作治疗胃酸过多的药剂 |
| B.氯化铝是电解质,可电解其水溶液获得金属铝 |
| C.SO2具有漂白性,可用于将银耳漂白为“雪耳” |
| D.二氧化硅具有导电性,可用于生产光导纤维 |
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
| A.1.0mol·L -1的HNO3溶液:NH4+、[Ag(NH3)2]+、Cl-、SO42- |
| B.c(H+)/c(OH-)=10-11的溶液:Na+、Ba2+、NO3-、Cl- |
| C.滴入酚酞显红色的溶液:Ca2+、Al3+、NO3-、HCO3- |
| D.滴入碘化钾淀粉溶液显蓝色的溶液:Na+、Fe2+、ClO-、SO42- |
下列有关化学用语表示正确的是
| A.含18个中子的氯原子的核素符号:17 35Cl |
B.14C的原子结构示意图: |
C.次氯酸的电子式:  |
D.间羟基苯甲酸的结构简式: |