工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
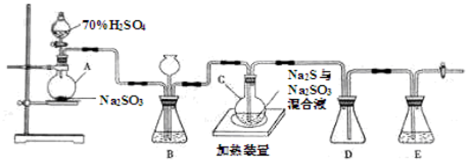
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq) Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有 。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
下表是50 mL稀硫酸与0.10 g某金属反应的实验数据:
| 实验 序号 |
金属 状态 |
c(H2SO4) /mol·L-1 |
溶液温度/℃ |
金属消失 的时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
丝 |
0.7 |
20 |
36 |
250 |
| 2 |
丝 |
0.8 |
20 |
35 |
200 |
| 3 |
粉末 |
0.8 |
20 |
35 |
25 |
| 4 |
丝 |
1.0 |
? |
35 |
125 |
| 5 |
丝 |
1.0 |
35 |
50 |
50 |
分析上述数据,回答下列问题:
(1)实验2和3表明,对反应速率有影响,反应速率越快;
(2) 实验4中“?”处的温度分别是℃。
(3) 仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);
(4) 本实验中影响反应速率的其他因素还有,其实验序号是。
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
a极是极,b极是极,
负极反应式为:。
某研究性学习小组欲探究原电池的形成条件,按右图所示装置进行实验并得到下表实验结果:
| 实验 序号 |
A |
B |
烧杯中的液体 |
 灵敏电流计指 灵敏电流计指针是否偏转 |
| 1 |
Zn |
Cu |
稀硫酸 |
有 |
| 2 |
Zn |
Cu |
乙醇 |
无 |
| 3 |
Cu |
C |
氯化钠溶液 |
有 |
| 4 |
Mg |
Al |
氢氧化钠溶液 |
有 |
分析上述数据,回答下列问题:
(1)实验1中电流由极流向极(填“A”或“B”)
(2)实验4中电子由B极流向A极,表明负极是电极(填“镁”或“铝”)
(3)实验3 表明
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是会发生的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256KJ的热量。反应的热化学方程式为。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是a kJ·mol-1,H-H键的键能是b kJ·mol-1;N-H键的键能是c kJ·mol-1。由N2和H2合成1mol NH3时可放出kJ的热量。
今有Fe和Zn的混合物12.1g,与足量的稀盐酸反应,共放出H2 4.48L(标准状况)。求:
(1)原混合物中Fe的质量分数。
(2)消耗HCl的物质的量。