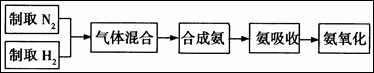
实验室模拟合成氨和氨催化氧化的流程如下:


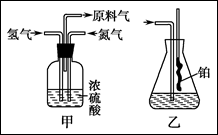
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
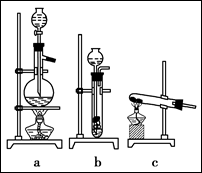
(1)从上图中选择制取气体的合适装置:
氮气 、氢气 。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、 。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨, (填“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式: 。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
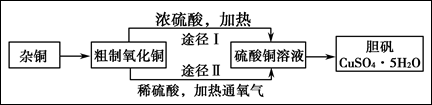
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
A.蒸发皿
B.石棉网
C.泥三角
D.表面皿
E.坩埚钳
F.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 。
A.灼烧过程中部分氧化铜被还原
B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜
D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是 。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
实验室里需要纯净的氯化钠溶液,但现有的氯化钠晶体中混有少量硫酸钠和碳酸氢铵,设计一组实验去杂质。试简单回答下列问题。
(1)除去碳酸氢铵,用加热方法好,还是加入强碱微热的方法好?
答:______________,原因是____________________,判断碳酸氢铵已完全除去的方法是__________________________。
(2)加热的固体残渣溶于水后,应该用氯化钡溶液还是硝酸钡溶液除去SO42-?
答:_____________,原因是______________,判断SO42-已完全除去的方法是_________。
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分: 

请回答以下问题:
(1)混合粉末A中硫粉过量的原因是;
(2)反应在“惰气环境”中进行的原因是;
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明__________;
(4)操作②的作用是__________。反应方程式是。也可改用加入__________
(5)操作③稀H2SO4煮沸的目的是;
(6)为证明产物中铁的价态,对D溶液的实验操作最好是。
(1)欲证明铁、铜、银三种金属的活动性顺序,应该选用的试剂是,化学方程式是。
(2)将碎蛋壳放到盛有食醋(含CH3COOH)的家用杯子中,会产生一种能使澄清石灰水变浑浊的无色气体,可推知蛋壳的化学成分中含有。完成上述两个离子方程式:。如果给你少量澄清石灰水,你在家里如何操作可验证上述实验中产生的气体?简述操作过程:
。
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体,流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请完成下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入_______,目的是_____________。
(2)反应中加入过量的乙醇,目的是_____________________________________________。
(3)如果将上述实验步骤改为蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加醋酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是____________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
试剂a是_________________,试剂b是__________________,分离方法①是_______________,分离方法②是__________________,分离方法③是__________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是_____________________________。
可用下图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。
请填空:
(1)试管a中需要加入浓硫酸,冰醋酸和乙醇各2 mL,正确的加入顺序及操作是
______________________________________________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_________________。
(3)实验中加热试管a的目的是:
①____________________________________________________________________________;
②____________________________________________________________________________。
(4)试管b中加有饱和Na2CO3溶液,其作用是___________________________________。
(5)反应结束后,振荡试管b,静置。观察到的现象是______________________________。