铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
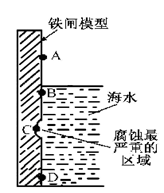
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
某化学探究学习小组设计如下图装置制取硝酸(夹持和加热仪器均已略去)。实验中可供使用的药品有:Na2CO3、NaHCO3、NH4HCO3、Na2O2、NaOH溶液和水。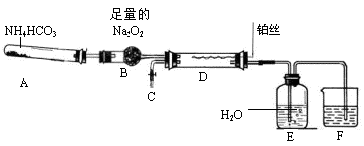
请回答下列问题:
(1)装置A中发生的化学反应方程式是。
(2)撤去装置D中的加热装置后,铂丝仍然保持红热,这是因为D中发生的化学反应是一个(填“放热”或“吸热”)反应。
(3)装置F中盛放的是溶液,其作用是。
(4)实验过程中,要使NH4HCO3充分转化为HNO3,还要在装置D中通入过量的氧气。甲同学提议在C处连接一个制取氧气的装置,乙同学认为可直接在A中再加入上述提供药品中的一种物质,这种药品的化学式是
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响 因素,某同学做了如下探究实验:
因素,某同学做了如下探究实验:
| 序号 |
内容 |
实验现 象 象 |
| 1 |
常温下将铁丝放在干燥空气中一个 月 月 |
干燥的铁丝表面依然光亮 |
| 2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
| 3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
| 4 |
将潮湿的铁丝放在高于常温的空气中一小时 |
铁丝表面已变得灰暗 |
| 5 |
将浸过氯化 钠溶液的铁丝放在高于常温的空气中一小时 钠溶液的铁丝放在高于常温的空气中一小时 |
铁丝表面灰暗程度比实验4严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号);在电化学腐蚀中,负极反应是;
(2)由该实验可知,可以影响铁锈蚀速率的因素是。
(3)为防止铁的锈蚀,工业上普遍采用的方法是(答两种方法)。
(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO3- )变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小;④先逐渐减小,而后增大。4种趋势中可能的是 。
(2)pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是 。
②分别用pH为0.1的NaOH溶液中和,其中消耗NaOH溶液最多的是 。
③反应开始时,反应速率 。
| A.HCl最快 | B.H2SO4最快 | C.CH3COOH最快 | D.一样快 |
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_________
(填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视 _______________________________判断到达滴定终点的依据是:__________________________________________________。
(4)以下是实验数据记录表
| 滴定次数 |
盐酸体积(mL) |
NaOH溶液体积读数(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.00 |
18.10 |
| 2 |
20.00 |
0.00 |
16.30 |
| 3 |
20.00 |
0.00 |
16.22 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是()
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5) 根据上表记录数据,通过计算可得,该盐酸浓度为:____________mol·L-1
乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
请回答:
⑴滴定时,将KMnO4标准液装在下图中的(填“甲”或“乙”)滴定管中。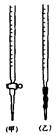
⑵本实验滴定达到终点的标志是
⑶通过上述数据,计算出x=。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会