一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159g/cm3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280mL/mL水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制造一氯甲烷:
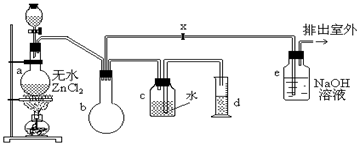
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式 ,其反应类型属于 反应;
(2)装置b的作用是 ;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为 ;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是 ;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是 ;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~
浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是 ;
(7)实验结束后,d中收集到的液体中含有 。
(本题8分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来 ,将乙针筒内的物质压到甲针筒内,进行下表所列的不伺实验(气体在同温同压下测定)。
,将乙针筒内的物质压到甲针筒内,进行下表所列的不伺实验(气体在同温同压下测定)。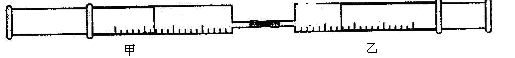
试回答下列问题:
(1)实验1中,沉淀最终变为:色,写出沉淀变色 的化学方程式。
的化学方程式。
(2)实验2中,已知:3Cl2+2NH3=N2+6HCl。甲针筒除活塞有移动, 针筒内有白烟产生外,气体的颜色变化为,最后两个针筒中共剩余气体的体积约为mL。
(本题2分)下列有关实验的叙述,正确的是(填序号).()
| A.浓硫酸不小心沾到皮肤上,立即用稀NaOH溶液洗涤 |
| B.用重结晶法提纯含少量NaCl的KNO3晶体 |
| C.用分液漏斗将甘油和水的混合液体分离 |
| D.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比 |
E.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下: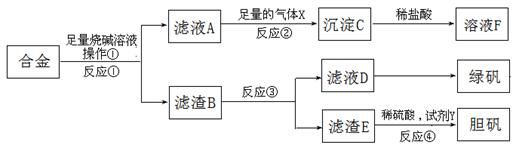
请回答:
(1)操作①用到的玻璃仪器有。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式。
(3)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是。
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________;
②该同学的判断不正确,原因是_________________;
(4)请设计实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象______。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第一小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是________________________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3__________。
(3) 设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:
设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:
上述方案是否合理?________ (若不合理,请说明理由;若合理,以下不用回答)
①
②