某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2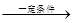 CH3CH2CH2CHO
CH3CH2CH2CHO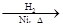 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;
CO的制备原理:HCOOH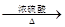 CO↑+H2O,并设计出原料气的制备装置(如图)
CO↑+H2O,并设计出原料气的制备装置(如图)
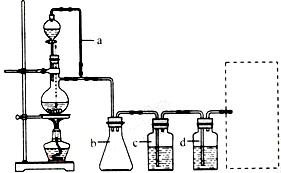
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氦气,丙烯。写出化学方程式: , 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , ;
C和d中承装的试剂分别是 , 。若用以上装置制备H2气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集H2干燥的装置图。
(3)制丙烯时,还产生少量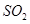 ,
,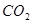 及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①饱和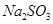 溶液
溶液
②酸性 溶液
溶液
③石灰水
④无水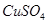
⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______________。
a. 低温、高压、催化剂 b. 适当的温度、高压、催化剂
c. 常温、常压、催化剂 d. 适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化10-丁醇,该小组查阅文献得知:
①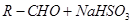 (饱和)→
(饱和)→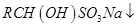 ;
;
②沸点:乙醚34°C,1-丁醇118°C,
并设计出如下提纯路线:
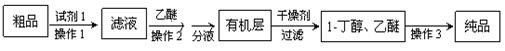
试剂1为_________,操作1为________,操作2为_______,操作3为_______。
某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。
请回答:
(1)实验室制备氨气的化学方程式为;干燥氨气常用的干燥剂是。
(2)收集氨气时,请你选择氨气的进气口(填“a”或“b”),理由是。
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是(填序号)。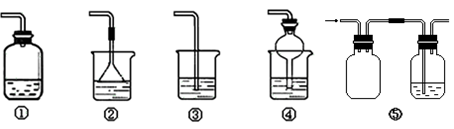
(5)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式。
某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律;同一周期内从左到右元素金属性的递变规律;同一主族内从上到下元素非金属的递变规律。
| 实验方法(Ⅰ) |
实验现象(Ⅱ) |
| 1、钠与冷水反应 |
a、溶液变红色 |
| 2、向NaOH溶液中滴加酚酞 |
b、产生白烟 |
| 3、向新制H2S饱和溶液滴加新制的氯水 |
c、反应不十分剧烈,产生的气体能燃烧,溶液变成[ 浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
| 4、镁带在空气中燃烧 |
d、产生大量气泡、气体可以燃烧 |
| 5、NaI溶液中加入溴水和CCl4 |
e、下层溶液变橙色 |
| 6镁带与沸水反应,再向反应后溶液中滴 加酚酞。镁与2mol/L盐酸反应。 |
f、浮于水面,熔成小球,迅速向四处游动 |
| 7、蘸浓氨水与浓盐酸的两玻璃棒接近 |
g、下层溶液变紫色 |
| 8、NaBr溶液中加入氯水和CCl4 |
h、发出耀眼的强光,生成白色物质 |
| 9、铝片与2mnol/L盐酸反应 |
i、生成淡黄色沉淀 |
回答下列问题
(1)从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(有几个填几个,不一定把空格填满)。
| 1、探究同一周期从左到右元素金属性的递变规律 |
2、探究同一主族内从上到下元素非金属性的递变规律 |
|||||||
| Ⅰ |
||||||||
| Ⅱ |
(2)实验结论(表示元素具体的强弱顺序):金属性:____________________非金属性:
(3)上表(Ⅰ)中实验方法9反应的离子方程式
(4)上表(Ⅱ)中实验现象e反应的离子方程式
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水、易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水)。请填写下列空白:
⑴烧瓶a中发生的是乙醇制取乙烯的反应,写出该反应的化学方程式:。
⑵写出制备1,2-二溴乙烷的化学方程式:。
⑶安全瓶b可以防倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:。
⑷锥形瓶c中NaOH溶液的作用是:。
⑸某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因。
(10分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________;装置的不足之处是;不加以改正,所求的值将 (填偏大,偏小,无影响)。
(2) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会________(填“相等”或“不相等”)。
在实验室里,某同学取一小块金属钠,做钠与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是,所发生反应的化学方程式是。
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是
①________________________________________________,
②_____________________________________________________。
(3)将一小块钠投入盛有CuSO4溶液的烧杯中,不可能观察到的现象是________。
| A.有气体生成 |
| B.钠熔化成小球并在液面上游动 |
| C.烧杯底部有红色的金属铜生成 |
| D.溶液中有蓝色浑浊 |
(3)钠与CuSO4溶液反应的有关的离子反应方程式为