将下图所示实验装置的 K 闭合,下列判断正确的是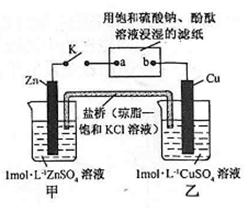
| A.Cu 电极上发生还原反应 |
| B.电子沿 Zn→a→b→Cu 路径流动 |
| C.片刻后甲池中c(SO42-)增大 |
| D.片刻后可观察到滤纸b点变红色 |
胶体区别于其它分散系的本质特征是
| A.胶体的分散质能透过滤纸 | B.胶体能产生丁达尔现象 |
C.胶体的分散质粒子直径在1~1 00mm之间 00mm之间 |
D.胶体是纯净物,其它分散系是混合物 |
下列各组 物质中,均为纯净物的一组是
物质中,均为纯净物的一组是
| A.碘酒干冰 | B.液氯浓硫酸 |
| C.石灰石氨水 | D.CuSO4·5H2O NaNO3 |
西维因是一种高效低毒杀虫剂,在碱性条件下可水解:
有关说法正确的是
| A.西维因分子式为C12H10NO2 |
| B.反应后经酸化,可用FeCL3溶液检验是否发生水解 |
| C.1mol西维因最多能与6mol氢气发生加成反应 |
| D.西维因分子中至少有21个原子共平面 |
用括号内试剂和方法除去下列各物质中的少量杂质,正确的是
| A.甲烷中的甲醛(水,洗气) |
| B.乙烷中的乙烯(酸性高锰酸钾溶液,洗气) |
| C.乙酸乙酯中的乙酸(NaOH溶液,分液) |
| D.苯中的苯酚(浓Br2水,过滤) |
下列反应的离子方程式正确的是
| A.苯酚与氢氧化钠溶液反应 C6H5OH+OH— →C6H5O—+H2O |
| B.碳酸钙溶于醋酸 CaCO3+2H+=Ca2++CO2↑+H2O |
| C.碳酸钠溶液加入过量的苯酚 2C6H5OH+CO32—→2C6H5O—+ CO2↑+H2O |
| D.甲醛溶液中加入足量的银氨溶液并加热: |
HCHO+2[Ag(NH3)2]++2OH-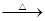 HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O