以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是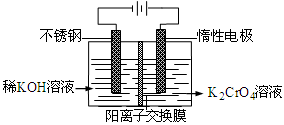
A.在阴极式,发生的电极反应为:2H2O+2e- 2OH―+H2↑ 2OH―+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2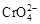 +2H+ +2H+ 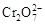 +H2O向右移动 +H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+2O2↑ 2K2Cr2O7+4KOH+2H2↑+2O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α= |
下列关于工业生产的叙述中错误的是( )。
| A.制普通玻璃的主要原料是纯碱、石灰石、石英砂 |
| B.工业上电解熔融的氯化钠来制取钠 |
| C.将二氧化硫催化成三氧化硫后,在吸收塔内用水吸收制得浓硫酸 |
| D.制造普通水泥的主要原料是黏土、石灰石 |
磷酸钙是陶瓷,也是一种复合材料,它可用于制人造骨骼,这是利用了这类材料的( )。
| A.耐高温的特性 | B.电学特性 | C.光学特性 | D.生物功能 |
2009年10月6日,诺贝尔物理学奖授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德·博伊尔和乔治·史密斯。光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是( )。
| A.工业上用二氧化硅制取单质硅时,1 mol C理论上能置换出1 mol Si |
| B.6 g的二氧化硅中含有0.4NA个共价键 |
| C.二氧化硅是H2SiO3的酸酐,因此能与碱反应,不能与任何酸反应 |
| D.由于硅酸比碳酸弱,故二氧化硅不能与碳酸钠反应 |
以氮化硅(Si3N4)和氧化铝(Al2O3)为原料,采用高压烧结或热压工艺制备赛伦。赛伦的化学通式为Si6-xAlxOxN8-x,以耐高温、高强度、超硬度、耐磨损、抗腐蚀等性能为主要特征,因此,在冶金、机械、光学、医学等领域有重要应用。它属于( )。
| A.金属材料 | B.有机高分子材料 |
| C.新型无机非金属材料 | D.无机高分子材料 |
汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是( )。
| A.用盐的形式表示:BaSiO3·CuSiO3 |
| B.用氧化物形式表示:BaO·CuO·2SiO2 |
| C.易溶于强酸、强碱 |
| D.性质稳定,不易褪色 |