铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s) =3AlCl(g)+3CO(g) △H="a" kJ·mol-1
3AlCl(g)=2Al(l)+AlC13(g) △H="b" kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为 。
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6. 0 mol·L-1 HCl 溶液中,混合物Y能完全释放出H2。1 mol Mg17 Al12完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为 。
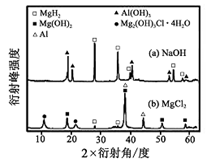
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH 溶液中,混合物Y 中产生氢气的主要物质是 (填化学式)。
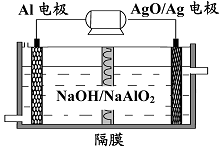
(3)铝电池性能优越,Al-AgO 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。
小玲到了傍晚时就看不见东西,患了夜盲症。可能的原因之一是她的体内缺乏维生素;小可同学近期感到精神不振、疲劳、头晕、面色苍白,医生说她患了贫血病,此时她应该多补充蛋白质和含__________丰富的无机盐。
(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理____________。
(2)工业上为了处理含有Cr2O72-的酸性工业废水, 用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为_________________________________。
②常温下,Cr(OH)3的溶度积Ksp =1×10—32,溶液的pH至少为,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L—1的废水,需用绿矾的质量为kg。(写出计算过程,保留到小数点后一位)
(1)25℃时,pH=12.0的KOH溶液中,由水电离出的c(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的c(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:。
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)。
(3)FeCl3的水溶液呈(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):。
下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH2K2CO3+6H2O
(1)写出下列电极反应式:通入CH3OH 的电极的电极反应式是:,
B(石墨)电极的电极反应式为:。
(2)乙池中反应的化学方程式。
(3)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上转移电子mol。
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g)ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l)ΔH=-44.0KJ·moL-1
(1)氢气的燃烧热△H=。
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式。
(3)往1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为;反应达到平衡后,升高温度,此时平衡常数将(填“变大”、“不变”或“变小”),平衡将向(填“正”或“逆”)反应方向移动。
(4)为了提高CO的转化率,可采取的措施是。
| A.增大的CO浓度 | B.增大H2O(g) 的浓度 |
| C.使用催化剂 | D.降低温度 |
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以氢氧化钾为电解质溶液,其负极的电极反应式是。