元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;
制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
有一瓶无色气体,可能含有CO2,HCl,HBr,SO2 中的一种或几种气体,将气体通入适量氯水中,得到无色透明的溶液,继续向该溶液中加入少量的BaCl2溶液和盐酸,有白色沉淀产生。则原气体中一定含有__________,肯定不含有__________。
如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质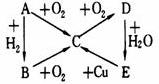
当A是气体单质时,B是______,C是_____,E是______。
浓硫酸在下列用途和现象中所表现的性质是(用编号填写)
| A.沸点高、难挥发 | B.酸性 | C.吸水性 | D.脱水性 E、强氧化性 |
| 用途或现象 |
体现浓硫酸的性质 |
| (1)浓硫酸使蓝矾变成白色 |
|
| (2)浓硫酸使木条变黑 |
|
| (3)浓硫酸制HCl |
|
| (4)浓硫酸与铜片共热 |
|
| (5)浓硫酸与木炭共热产生气体 |
写出有关的元素符号或名称
(1)某元素最外层电子数是次外层电子数的2倍,该元素符号是。
(2)某元素K层与M层电子数相同,该元素名称是。
写出下列反应化学方程式:
⑴二氧化氮和水反应:;
⑵碳和浓硝酸共热:;
⑶铜和稀硝酸反应:;