X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧反应的热化学方程式:
____________________________________________。
(5)ZX的电子式为_______;ZX与水反应放出气体的化学方程式为___________________。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2  Fe + 2ZG ;放电时,电池的正极反应式为_____________________:充电时,_________(写物质名称)电极接电源的负极;该电池的电解质为____________。
Fe + 2ZG ;放电时,电池的正极反应式为_____________________:充电时,_________(写物质名称)电极接电源的负极;该电池的电解质为____________。
(10分)一定温度时,在容积一定的密闭容器中,反应A(s)+B(g) C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是(填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是。
(2)能判断该反应一定达到平衡状态的依据是。(填写字母编号)
A.体积分数组成C%=D%
B.单位时间内生成n moAl的同时生成n molC
C.温度和体积一定是,某一生成物浓度不再变化
D.温度和体积一定是,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如右图所示。
T2时改变了某种条件,改变的条件是。(填写字母编号)
A.升温 B.加压 C.催化剂D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是。
(10分)氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度(填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中
2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。
则该反应的热化学方程式是。
(4)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。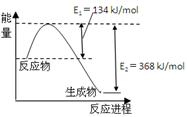
已知:N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
2NO (g)+O2(g)=N2(g)+2CO2(g)△H=-112.3kJ/mol
则反应:2NO(g)+CO(g) N2(g)+2CO2(g)的△H是。
N2(g)+2CO2(g)的△H是。
(10分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是 。
(2) CO2分子中碳原子的杂化类型是 杂化。
(3) 按电子排布Zn在元素周期表中属于 区,其晶体属于六方最密堆积,它的配位数是 。
(4) Cu的一种氯化物晶体的晶胞结构如右图所示(空心球代表氯离子),则一个晶胞中所含的数目是 。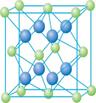
(8分)已知X、Y、Z、M、W、R是前四周期中的六种元素。X元素原子形成的离子是一个质子,Y原子的价电子构型为2s22p2,Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的。
(1)24R原子最外层的电子排布图是 ,ZO3-的空间构型是 ;
(2) Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是 ;Y、Z、W三种元素的电负性由大到小的顺序是 。(填元素符号)
(3) Ne与Wn-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是 。(填化学式)
(4)ZX4W在物质中,各种粒子间的相互作用力包括 。(填字母编号)
| A.非极性共价键 | B.极性共价键 | C.配位键 | D.离子键 E.氢键 |
在830K时,下列反应的平衡体系具有某些特殊性:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
①若起始浓度分别为c(CO)=3 mol·L-1,c(H2O)=0.75mol·L-1,达到平衡后CO的转化率为20%
②若起始浓度分别为c(CO)=3 mol·L-1,c(H2O)=4.5mol·L-1,达到平衡后CO的转化率为60%
设830K时,以起始浓度分别以c(CO)=a mol·L-1,c(H2O)=b mol·L-1投料,发生以上反应,测得平衡后c(H2)=c mol·L-1.
请注意上述数据,总结出其中规律,填写以下空白。
(1)选择填空:在多次试验中,若保持b不变而减小a,则达到平衡时CO的转化率________ 水蒸气的转化率________.
| A.增大 | B.减小 | C.不变 | D.无法确定 |
(2)当a=4,c=1.5时,b=______________.
(3)当a=2b时,a∶c=______________.
(4)a、b、c在该平衡中的关系式是__________________.