合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3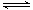 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式______________________。
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
t℃时,将3molA和2molB气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气)  xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)x=__________。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)________α(B)(填>、=或<)
(3)若继续向原平衡混合物的容器中通人少量氦气(氦气和A、B、C)都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)在t℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入__________(填A或B)________mol(用a表示),
有pH=1的①盐酸 ②硫酸 ③醋酸
(1)设三种溶液的物质的量浓度分别为a、b、c,则其大小关系为 。
(2)同体积的三种溶液与足量的NaOH溶液反应生成盐的物质的量分别为a、b、c,则其大小关系为 。
(3)完全中和物质的量浓度和体积都相同的NaOH溶液时,需三种酸溶液的体积分别为a、b、c,则其大小关系为 。
pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加_________mL;
(2)如果加入pH=10的NaOH溶液,应加_________mL;
复方铝酸铋片是一种抗酸药,每片中含铝酸铋200mg ,碳酸镁400mg,碳酸氢钠200mg,甘草流浸膏粉300mg,弗朗鼠李皮25mg 。
(1)该抗酸药的有效成分是 (用化学式表示)
(2)请写出其有效成分与盐酸反应的化学方程式(任写一个)
油脂在________条件下水解发生皂化反应;坏血病是缺乏___ _____所引起的,儿童缺乏维生素D时易患_____ ___;铁是_____ ___ __的主要组成成分,对维持人体所有细胞正常的生理功能是十分必要的。