已知25 ℃时,电离常数Ka(HF)=3.6×10-4mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.O×10一16。下列说法正确的是
| A.25 ℃时,O.1 mol·L-1 HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 |
| B.向1 L0.2 mol·L-1 HF溶液中加入1 L O.2 mol·L-1 CaCl2溶液,没有沉淀产生 |
| C.AgCl不溶于水,不能转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 mol·L-1 mol·L-1 |
甲、乙、丙、丁分别是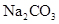 、
、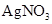 、
、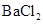 、
、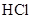 四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙
四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙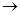 沉淀;甲+丙
沉淀;甲+丙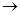 沉淀;乙+丙
沉淀;乙+丙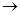 沉淀;丙+丁
沉淀;丙+丁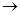 沉淀;乙+丁
沉淀;乙+丁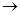 无色无味气体。则甲、乙、丙、丁四种溶液依次是()
无色无味气体。则甲、乙、丙、丁四种溶液依次是()
A.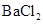 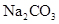 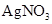 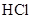 |
B.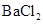 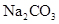 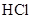 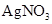 |
C.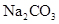 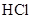  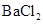 |
D.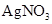 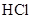 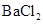 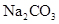 |
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是( )
| A.①②③④ | B.①②⑤⑥ | C.③⑤⑥⑦ | D.①③④⑦ |
某澄清溶液,可能含有 、
、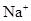 、
、 、
、 、
、 中的一种或几种,现分别取少量溶液做如下实验: ①通人足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色②加入
中的一种或几种,现分别取少量溶液做如下实验: ①通人足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色②加入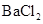 有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。③用铂丝醮取少量溶液置于酒精灯火焰中灼烧,火焰的颜色呈黄色④加入
有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。③用铂丝醮取少量溶液置于酒精灯火焰中灼烧,火焰的颜色呈黄色④加入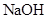 溶液并加热,无明显现象。下列关于该澄清溶液的说法不正确的是()
溶液并加热,无明显现象。下列关于该澄清溶液的说法不正确的是()
A.一定含有 |
B.一定含有 |
C.一定含有 |
D.一定含有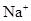 |
已知反应 ,
, ,下列物质氧化性强弱顺序正确的是()
,下列物质氧化性强弱顺序正确的是()
A. |
B. |
C. |
D. |
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象相同的是()
| A.AgNO3溶液和稀氨水 | B.AlCl3和NaOH |
| C.Na[Al(OH)4]和H2SO4 | D.Ba(HCO3)2和Ba(OH)2 |