【化学——选修3:物质结构与性质】磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。回答下列问题:
(1)上述反应物中的一种元素,其基态原子具有八种不同能量的电子,写出其基态原子的价电子排布式 。
(2)BP中每个B或P原子均形成几个共价键,其中有一个配位键,其中提供孤电子对的是 原子。
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B(填“>”、“<”)
(5)BBr3分子中,键角为 ,为 (填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。
8.4 g N2与9.6 g某单质RX,所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是,x值为。
有五种物质① 0.5 mol CO2, ② 6 g H2,③ 10 ml H2O,④ 1.024×1024 个HCl,⑤147 g H2SO4,它们中物质的量最大的是_________,所含分子数最多的是_______,含有原子数最多的是___________,质量最大的是_____________。(用序号填空)
填充下列表格
| 物质 |
粒子数(个) |
质量(g) |
物质的量(mol) |
摩尔质量(g/mol) |
| 氩气 |
0.2 |
|||
| S |
1.204×1023 |
|||
| CO2 |
22 |
|||
| C12H22O11 |
0.25 |
设NA表示阿伏加德罗常数的数值,其计算近似值为6.02×1023。按要求完成下列填空:
(1)1 mol Cl2中含有个氯气分子,约含有个氯原子。
(2)0.5 mol NH3中含有个氨分子,共约含有个原子。
(3)3 mol NO和mol NO2所含有的原子数相等。
(4)6mol H2O与mol NH3所含氢子数相等。
(5)某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是 。
(6)1.204×1024个水分子的物质的量是。1molH2SO4中氧原子数为。
(7)1molMgCl2中氯离子数为,离子总数约为。
(8)1mol CuSO4·5H2O含有个Cu2+,含有_____mol水分子。
(9)2molCO(NH2)2中含mol碳原子,mol氧原子,mol氮原子,___mol氢原子。
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。
请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是。
(3)B分子的空间构型为形,该分子属于分子(填“极性”或“非极性”) 。
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式,该反应中反应物Cu的基态原子电子排布式为。铜晶体中铜原子的堆积方式为面心立方堆积,下图是铜晶体一个晶胞的示意图,则晶胞中含个铜原子。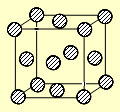
(5)D分子中心原子的杂化方式是,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为。