电化学降解NO3-的原理如图所示。下列说法中正确的是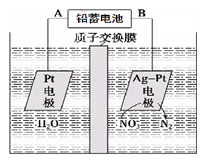
| A.铅蓄电池的A极为负极,电极材料为Pb |
| B.铅蓄电池工作过程中每通过电路中2mol电子则消耗1molH2SO4 |
| C.该电解池的阴极反应为2NO3- + 12H++ 10e- = N2↑ + 6H2O |
| D.若电解过程中转移5moL电子,则交换膜两侧电解液的质量变化差(Δm左—Δm右)为14.4g |
元素的原子结构决定其性质和周期表中的位置,下列有关结构和性质的说法中,正确的是
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.元素周期表中,第三周期最右端的元素得电子能力最强 |
| C.最易失去的电子能量最高 |
| D.目前使用的元素周期表中最长的周期含有36种元素 |
下列有关化学用语表示正确的是
A.S2-的结构示意图: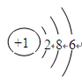 |
| B.原子核内有10个中子,8个质子的原子:18 8O |
| C.HSO3-的电离方程式:HSO3-= H++SO32- |
| D.2gH2在25℃101kPa下燃烧,生成液态的水放出285.8kJ·mol-1的热量,则该反应的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ·mol-1 |
下列关于物质的分类说法中,正确的是
| A.SO2、NO2是酸性氧化物 |
| B.分散系一定是混合物 |
| C.盐酸能导电,是电解质 |
| D.最外层电子数少于4的元素一定是金属元素 |
下列说法正确的是
| A.电离是电解质离解成能够自由移动的离子的过程,与是否通电无关 |
| B.有单质参加的反应,均为氧化还原反应 |
| C.阿伏加德罗常数是6.02×1023 |
| D.氢氧化铝是两性氢氧化物,氧化铝是两性氧化物,铝也是两性金属 |
将一浅绿色溶液,置于空气中,变黄色。将此黄色溶液逐滴滴入沸水中,形成一种红褐色胶体,下列说法中错误的是
| A.该浅绿色溶液中含有Fe2+在空气中被氧化为Fe3+ |
| B.欲检验该黄色溶液中,是否含有未被氧化的Fe2+,向其中滴加KSCN溶液 |
| C.配制该浅绿色溶液,要向其中加少量酸与铁粉,目的是为了防止Fe2+的水解与氧化 |
| D.欲检验浅绿色溶液中是否含有Fe3+,滴入KSCN溶液,看是否变红色 |