ToC时,在一固定容积的密闭容器中发生反应:A(g)+B(g) C(s) ∆H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s) ∆H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
A.ToC时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于ToC
D.ToC时,直线cd上的点均为平衡状态
下列叙述正确的是
| A.NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 |
| B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| C.加水稀释CH3COONa溶液,溶液中的所有离子浓度都减小 |
| D.金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 |
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
| B.一定温度下,1 L 0.50 mol·L-1 NH4NO3溶液中含氮原子个数为NA |
| C.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA |
D.235g核素 U发生裂变反应: U发生裂变反应: U+ U+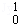 n n 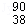 Sr+ Sr+ Xe+10 Xe+10 n,净产生的中子( n,净产生的中子(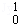 n)数为10NA n)数为10NA |
化学与生产、生活、社会密切相关。下列有关说法中正确的是
| A.在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 |
| B.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 |
| C.SO2具有漂白性,可用于漂白纸浆,也可以用于漂白食品 |
| D.纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
某溶液可能含有Cl-、SO、CO、NH、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 |
| B.SO、NH一定存在,Cl-可能不存在 |
| C.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1 |
| D.CO、Al3+一定不存在,K+可能存在 |
工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出。下列说法错误的是
| A.氧化性:H2SeO4>Cl2>H2SO3 |
| B.酸性:H2SO4>H2SeO4 |
| C.析出1mol硒需要消耗标准状况下22.4 L SO2 |
| D.亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸 |