已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
| A.X、Y、Z、W的原子半径依次减小 |
| B.W与X形成的化合物中只含离子键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
下列物质中,有固定沸点的是
| A.石蜡 | B.石炭酸 | C.聚氯乙烯 | D.石油 |
下列化学用语正确的是
A.锂离子的结构示意图: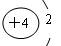 |
B.碳原子的轨道表示式: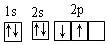 |
| C.丁烷的最简式:C2H5 | D.氯化镁的电子式:Mg2+[Cl]2— |
下列含有非极性键的共价化合物是
| A.HCl | B.Na2O2 | C.C2H2 | D.CH4 |
下列说法中正确的是
| A.钢、青铜、硬铝和金刚石都是合金材料 |
| B.所有的分解反应都属于氧化还原反应 |
| C.氨基酸不能通过缩聚反应结合成蛋白质 |
| D.一定条件下,稻草可制得葡萄糖或酒精 |
下列哪一项符合“绿色化学”的原则
| A.排放前对废气、废水、废渣进行无害化处理 |
| B.在化学生产中少用或不用有害物质以及少排放或不排放有害物质 |
| C.在化工生产中,尽量避免使用任何化学物质 |
| D.在化工厂范围多种草种树,努力构建花园式工厂 |