NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是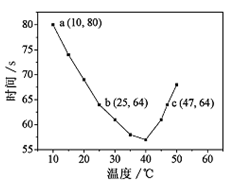
| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该试验的指示剂 |
根据下列反应事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
| A.X>Z>Y>W | B.Z>W>X>Y | C.Z>Y>X>W | D.Z>X>Y>W |
下列各个装置中能组成原电池的是
某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3 |
| B.正极为Cu,负极为Fe,电解质溶液为Fe(NO)3 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 |
| D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 |
如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是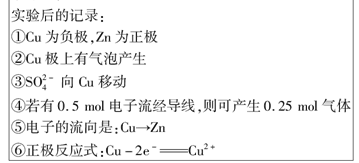
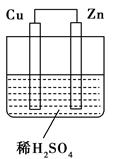
| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
下列说法正确的是
| A.流水、风力是一次能源,电力、蒸汽是二次能源 |
| B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池 |
| C.铅蓄电池是一次电池,氢氧燃料电池是二次电池 |
| D.同周期元素形成的简单离子中,原子序数越大的离子半径越小 |