已知A(g)+B(g)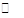 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)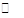 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
请回答下列问题:
(1)写出A的电子式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的化学方程式:
①;
②;
④。
(4)化学课外兴趣小组学生在实验室里制取的A中常混有少量的二氧化硫,老师启发他们设计了如右图实验以确认上述混合气体中有A和SO2。回答下列问题: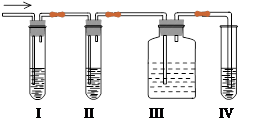
①I、II、III、IV装置可盛放的试剂是I;II;III;IV。(填字母)
A、品红溶液B、NaOH溶液C、浓硫酸D、酸性KMnO4溶液
②使用装置III的目的是。
甲酸甲酯水解反应方程式为:


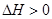
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表: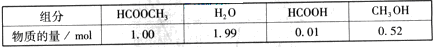
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图: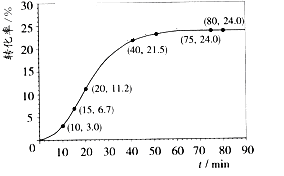
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
请计算15~20min范围内甲酸甲酯的减少量为mol,甲酸甲酯的平均反应速率为mol·min-1(不要求写出计算过程)。
(2)依据以上数据,推测该反应在10~40分钟间反应速率较快的原因:。
(1)0.3 mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,则其热化学方程式为
(2)又已知:H2O(g) =H2O(l) ; ΔH="-44" kJ/mol,则5.6L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是。
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
⑴A基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。
⑵某同学根据上述信息,所画的B电子排布图如图 ,违背了原理。
,违背了原理。
⑶F位于族区,其基态原子有种运动状态。
⑷CD3 中心原子的杂化方式为,用价层电子对互斥理论推测其分子空间构型为,检验E元素的方法是。
⑸若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为,该单质晶体中原子的堆积方式为四种基本堆积方式中的。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
室温下,单质A,B,C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图进行反应。又知E溶液是无色的,请回答: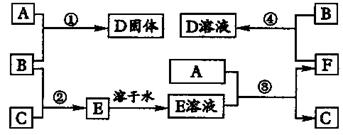
(1)A是、C是 (请填化学式)。
(2)反应①的化学方程式为:。
(3)反应③的化学方程式为:。
(4)反应④的化学方程式为:。