(6分)常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有 种粒子。
②溶液中有两种粒子的物质的量之和一定等于0.010mol,它们是 和 。
③溶液中n(CH3COO-)+n(OH-)- n(H+)= mol。
(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):______ ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
已知2A2(g) + B2(g) 2C(g)
2C(g) 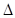 H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
(1)a b(填“>”“=”或“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将 (填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达到平衡后,吸收热量c kJ,C的浓度 w mol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:
(用等式表示)。
(4)能说明该反应已经达到平衡的状态的是 。
a.ν(C)=2ν(B2) b.容器内压强保持不变
c.ν(A2) (逆) =ν(B2) (正)d.容器内的密度保持不变
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧热的化学方程式为 。
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是 其中表示平衡混合物中NH3的含量最高的一段时间是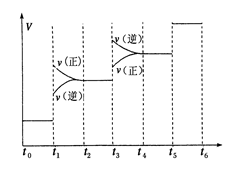
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为
现行中学教材中,有以下化学实验:
A.溴乙烷的水解
B.浓硫酸跟乙醇反应制乙烯
C.乙醛还原新制的氢氧化铜
D.乙酸乙酯的制取
E.石油的蒸馏
F.葡萄糖的银镜反应
G.乙酸乙酯的水解。
对以上实验,按下列各操作的要求,用字母A、B、C、——完成以下填空:(多填扣分)
(1)需用水浴加热的是 ;
(2)实验装置不需要检查气密性的是 ;
(3)为防止液体暴沸,常需加少量碎瓷片的是 ;
(4)需用温度计的是 。
(9分)实验室做乙醛和银氨溶液反应的实验时:
(1)为了得到光亮的银镜,试管应先用 溶液煮沸,倒掉煮沸液体后再用蒸馏水将试管冲洗干净。
(2)配制银氨溶液时向盛有 溶液的试管中逐滴滴加 溶液,边滴边振荡,直到 为止。有关反应的化学方程式为:① ;② 。
(3)加热时应用 加热。产生银镜反应的化学方程式 。