乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【查阅资料】电石主要成分为碳化钙(CaC2),它没有可燃性。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二: ;猜想三:Ca(OH)2。
他的依据是 。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是: 。
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到 ,证明猜想二不成立。
(二)取少量白色固体加入到水中,取上层清液,通入 ,有白色浑浊出现,证明猜想三成立。该反应的化学方程式为: 。
结论:白色固体是Ca(OH)2。
【拓展应用】某市一辆满载电石的货车遇大雨引发熊熊大火,其中的可燃物是________,且该反应放出大量热,使可燃物达到_______________。
【交流反思】通过上述实验可知,电石在保存和运输时的注意事项_ ___
化学材料和化学技术在智能房屋建设和家具生活中有着广泛的应用.
(1)智能房屋采用太阳能电池供电.生产太阳能电池需用纯硅.工业上由粗硅生产纯硅的工艺流程如图所示: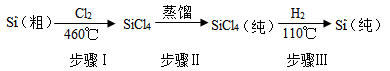
①上述步骤中属于物理变化的是步骤 ;
②写出步骤Ⅲ对应的化学方程式: ;
③与太阳能电池能量转化不同,火力发电是将化石燃料燃烧产生的 能转化为电能.
(2)有毒气体传感器可检测家用燃气不完全燃烧产生的有毒气体 (填化学式),并及时报警.
(3)新型碳纤维密度比铝小,强度是铁的20倍,具有抗电磁辐射、耐腐蚀的特点,化学性质与碳相似.新型碳纤维在智能房屋建设中可用作 (填下列选项字母).
A.建筑材料
B.电磁辐射屏蔽材料
C.防火材料
(4)饮用水净化系统中设备一和设备三的作用分别是 、 .
海水是资源的宝库,海水淡化可获得淡水和浓海水.浓海水中主要离子的浓度如下:
| 离子 |
Na+ |
Mg2+ |
Cl﹣ |
SO42﹣ |
| 浓度/g/L |
63.7 |
28.8 |
144.6 |
46.4 |
从浓海水中提取金属镁的一段工艺流程如图所示:
(1)补全由贝壳生产石灰乳的相应转化中所需的条件或反应物:
贝壳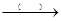 生石灰
生石灰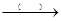 石灰乳
石灰乳
(2)写出反应1的化学方程式: .
(3)滤液X中溶质的主要成分有 (填化学式).
(4)物质Y的名称是 .
(5)将MgCl2溶液在一定条件下蒸发结晶、熔融电解可制得金属镁.则2L浓海水理论上可得到金属镁的质量为 g.
从微观的角度了解物质及其变化,更有助于认识物质组成和变化的本质.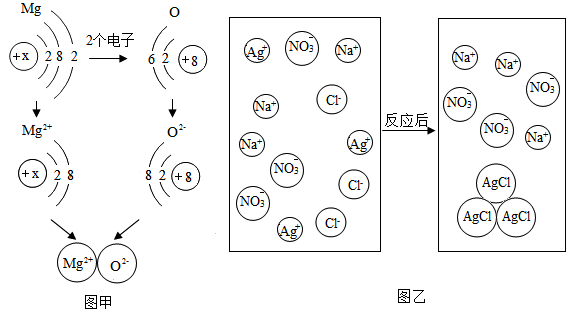
(1)图甲是镁原子和氧原子形成氧化镁的示意图.
①氧化镁的化学式为 ;图中的x= .
②从得失氧的角度看,镁与氧气的反应属于 反应;从得失电子的角度看,反应中镁原子 (填“得到”或“失去”)2个电子,形成相对稳定结构.
③由图甲可知,元素的原子得到电子后,其化合价将 (填“升高”或“降低”).
(2)图乙是NaCl与AgNO3两溶液反应的示意图.
①图中NO3﹣的名称是 .
②该反应的本质是 结合生成沉淀.
③写出与上述反应本质相同的另一化学方程式: (反应物之一为AgNO3).
实验室制取某些常见气体所使用的一些装置如图所示,根据所学知识回答下列问题.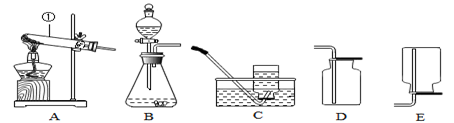
(1)写出图中标号①的仪器名称 .
(2)用胶皮管连接装置C中的玻璃导管时,应先把玻璃导管口 ,然后稍稍用力将玻璃导管旋入胶皮管中.
(3)实验室用B装置制取氧气的化学方程式是 .
(4)若用D装置收集二氧化碳,检验已集满的方法是 .
能源和环境成为人们日益关注的问题.目前煤炭在我国能源结构中占有的比例最大.
(1)我国正在推广家庭中用天然气逐步代替煤作燃料,天然气的主要成分是 .
(2)含硫煤燃烧会产生大气污染,其中二氧化硫排放到空气中会导致的环境问题是 .
(3)为防治该污染,某工厂设计了新的治污方法,不仅吸收了二氧化硫,还得到了某种化工产品, 该工艺流程如图所示:
①Fe2(SO4)3和H2O吸收SO2生成FeSO4和H2SO4的化学方程式是 .
②该过程中可得到的化工产品是 .
(4)为应对人们对能源和环保的需求,需要“节约现有能源、开发新能源、环保与发展共进”下列做法符合该理念的有 (填序号).
①屋顶安装太阳能发电装置
②焚烧田间秸秆,草木灰返田
③优化建筑设计,减少空调使用
④乘坐轨道交通,减少私家车使用.