将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应:N2+3H2 2NH3,下列关于该反应的说法中正确的是
2NH3,下列关于该反应的说法中正确的是
| A.增大压强,反应速率减小 |
| B.最终可生成0.2 mol NH3 |
| C.升髙温度,反应速率增大 |
| D.当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
1mol丙烯与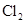 完全加成,其产物再与
完全加成,其产物再与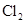 彻底取代,两个过程中共用
彻底取代,两个过程中共用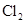 ( )
( )
| A.5mol | B.6mol | C.7mol | D.2mol |
下列叙述正确的是()
①在盛有硝酸银的烧杯中放入用导线连接的铜片和银片,正极质量不变。②相邻的同系物分子组成上相差一个CH2原子团③丙烯分子中三个碳原子在同一平面上,其一氯代物只有2种④由ⅠA族和ⅥA族短周期元素形成的原子个数比为1∶1,电子总数为38的化合物,是含有共价键的离子型化合物⑤等物质的量乙烷与氯气在光照条件下反应,可用这个方法制取一氯乙烷。
| A.①③ | B.②⑤ | C.①③ | D.②④ |
将一定质量的Ag2SO4固体置于容积不变的密闭容器中(加入少量V2O5),在某温度时发生下列反应:Ag2SO4(s) Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g) 2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( )
2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( )
| A.SO3的分解率为20% |
| B.容器内气体的密度为40g/L |
| C.达到平衡时分解的Ag2SO4固体为0.5mol |
| D.10min内用O2表示的该反应的反应速率为0.005mol/(L·min) |
已知H+ +OH- = H2O生成1 mol H2O放出热量57.3 kJ,下列反应中放出57.3 kJ热量的是( )
| A.1 mol稀H2SO4与足量NaOH溶液反应 | B.稀盐酸与氨水反应生成1 mol H2O |
| C.稀盐酸与稀Ba(OH)2溶液反应生成1 mol水 | D.稀NaOH与98.3%硫酸生成1 mol水 |
聚四氟乙烯的耐热性和化学稳定性超过其他塑料,被称为“塑料王”。其合成路线如下:
下列说法中,不正确的是( )
| A.“塑料王”不能使酸性高锰酸钾溶液褪色 |
| B.三氯甲烷(CHCl3)可以用甲烷与氯气的取代反应来制取 |
| C.四氟乙烯(CF2=CF2)中所有的原子都在同一平面上 |
| D.二氟一氯甲烷(CHClF2)中所有原子最外层都达到了8电子稳定结构 |