【改编】将等物质的量的A、B混合于1L的密闭容器中,发生反应:A(g)+ 3B(g) 2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
(1)科学研究表明,由于大量使用氟利昂使南极上空的臭氧层出现空洞。臭氧的化学式为O3。在同温同压下,相同质量的O2和O3的物质的量比为,
(2)HCl气体极易溶于水,若向水中通入标准状况下的44.8LHCl气体配成1L盐酸,所得盐酸的物质的量浓度为;取此盐酸250mL与小苏打(NaHCO3)反应,请计算最多可以产生二氧化碳的体积(标准状况)。
取含MnO2的软锰矿石116g跟足量浓盐酸反应(杂质不参与反应):
MnO2 + 4HCl (浓) = MnCl2 + Cl2 + 2H2O,制得71gCl2(标准状况),求:
(1)这种软锰矿石中MnO2的百分含量。
(2)被氧化的HCl的物质的量。
(3)参加反应的HCl的物质的量。
将0.1mol的镁铝混合物溶于100mL 2 mol·L-1的H2SO4中,然后再滴加1 mol·L-1的NaOH溶液。请回答: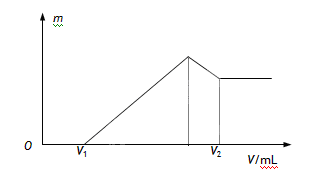
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=160mL时,则金属粉末中,n(Mg)=_______mol
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V (NaOH)=_______mL
向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol/L烧碱溶液,至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672L(标准状况)。据此计算:
(1)加入铝粉的质量。
(2)原硫酸铜溶液的物质的量浓度。
(8分)200℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体的质量增加了3.6 g ,求原混合气体中CO2和水蒸气的质量比?