【改编】短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则正确的是
| A.离子半径:丁>丙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙、丁的氧化物均只含有共价键 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH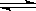 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向正反应方向移动 |
| B.加水,反应速率增大,平衡向逆反应方向移动 |
| C.滴加少量0.1mol/L HCl溶液,溶液中c(H+)减少 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
常温下某溶液中由水电离产生的[H+]=1×10-5mol·L-1,则下列叙述正确的是
| A.一定是碱溶液 |
| B.一定是酸溶液 |
| C.由水电离出的[OH-]=1×10-9mol·L-1 |
| D.pH值可能为9也可能为5 |
把下列溶液,溶液的pH值不会改变的是
| A.CH3COOH溶液 | B.NaCl溶液 | C.NaOH溶液 | D.FeCl3溶液 |
下列关于电离平衡常数(K)的说法中正确的是
| A.在一定温度,相同浓度时电离平衡常数(K)越大可以表示弱电解质电离程度越大 |
| B.电离平衡常数(K)与温度无关 |
| C.不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| D.多元弱酸各步电离平衡常数相互关系为K1<K2<K3 |
下列各式中属于正确的水解反应离子方程式的是
A.CH3COOH + OH-  CH3COO- +H2O CH3COO- +H2O |
B.S2-+2H2O H2S+2OH- H2S+2OH- |
C.CH3COOH+H2O CH3COO- +H3O+ CH3COO- +H3O+ |
D.NH4++H2O NH3· H2O+H+ NH3· H2O+H+ |