向50mL18mol/LH2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量 ( )
| A.小于0.45mol | B.等于0.45mol | C.在0.45mol和0.90mol之间 | D.大于0.90mol |
如图所示,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和有催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X(g)+Y(g) 2Z(g)+W(g);ΔH>0。达平衡时,A的体积为1.2aL。下列说法错误的是
2Z(g)+W(g);ΔH>0。达平衡时,A的体积为1.2aL。下列说法错误的是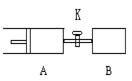
A.反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B中X的转化率大
C.打开K一段时间达到新平衡时,A的体积为1.6aL(连通管中体积不计)
D.打开K到新平衡后,升高B容器温度,A容器体积会增大
在密闭容器中,反应A(g)+2B(g) C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是
C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是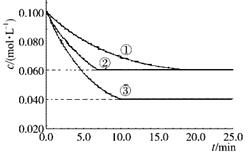
A.若反应①、②的平衡常数分别为K1、K2则K1<K2
B.反应A(g)+2B(g)  C(g)的ΔH >0
C(g)的ΔH >0
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)="0.060" mol·L-1
下列各表述与示意图一致的是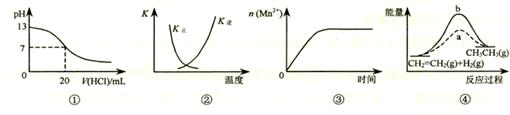
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0,正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0,正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
下列叙述正确的是
| A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b |
| B.常温下,某溶液中由水电离的c(OH-) = 1.0×10-13,则此溶液一定呈酸性 |
| C.25℃时,将pH=4的盐酸稀释1000倍后,溶液的pH=7 |
| D.25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与强酸的体积比是1:10 |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法错误的是
A.在冰醋酸中1mol/L的高氯酸的电离度约为0.4%
B.在冰醋酸中硝酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为:H2SO4===2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱