【化学—物质结构与性质】
氧元素在地壳中含量最多,含氧元素的物质种类也多如O2、H2O、H2O2等
I、(1)基态氧原子核外电子占有的轨道数 个。
II、化学反应A:Na2O2+H2O=2NaOH+H2O2 B:NH3+H2O=NH3·H2O
(2)反应A过程中断裂的化学键类型有 。
a.离子键 b.共价键 c.σ键 d.π键
(3)写出反应B中NH3的分子结构式 。
III、有一种氧单质O4其结构模型如图所示
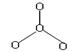
构型为平面正三角形,其物质的能量比O2高得多。
(4)中心氧原子杂化轨道类型是 。
(5)固体晶体类型属于 晶体。
(6)1molO22+含π键数目 。
主要元素
、
、
、
的原子序数一次增大,
的原子最外层电子数是次外层电子数的3倍。
、
和
分属不同的周期,他们的原子序数之和是
原子序数的5倍。在由元素
、
、
、
组成的所有可能的二组分化合物中,由元素
与
形成的化合物
的熔点最高。请回答下列问题:
(1)
元素原子的
层电子排布式为,
分子的空间构型为;
(2)
单质与水发生主要反应的化学方程式为;
(3)化合物
的化学式为,其晶体结构与
相同,而熔点高于
。
熔点较高的原因是。将一定量的化合物
负载在
上可制得
/
催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有,
的键角约为;
(4)
、
、
可形成立方晶体结构的化合物,其晶胞中
占据所有棱的中心,
位于顶角,
处于体心位置,则该晶体的组成为
︰
︰
=;
(5)含有元素
的盐的焰色反应为色。许多金属盐都可以发生焰色反应,其原因是。
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有、。
(2)天然水在净化处理过程中加入的混凝剂可以是其纯净水作用的原理是
(3)水的纯净和软化的区别是
(4)硬度为
的水是指每升水含10
或与之相当的物质(如7.1
)。若某天然水中
,
,则此水的硬度为;
(5)若(4)中的天然水还含有
,现要软化10
这种天然水,则需先加入
,后加入
。
某条件下,在2 L密闭容器中发生如下反应2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
在2L密闭容器内,800℃时反应:2NO2(g) 2NO(g)+O2(g)体系中,n (NO2)随时间的变化如表:
2NO(g)+O2(g)体系中,n (NO2)随时间的变化如表: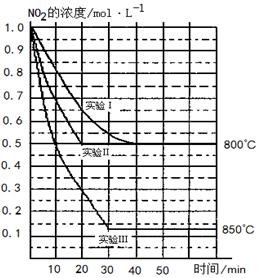
⑴实验Ⅱ隐含的反应条件是
⑵写出该反应的平衡常数表达式: K=。
该反应是________(填“吸” 或“ 放”)热反应。
⑶若实验Ⅰ中达平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),则平衡将移动。
⑷若将上述第⑶题所得的平衡混和气体通入足量的NaOH溶液中,使气体被完全吸收。
生成的产物及其物质的量为。
⑸NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转
化为无害的参与大气循环的物质,该反应的化学方程式为。
(任写一个)
A为某有机合成的中间体,分子内无支链,在一定条件下发生消去反应可能得到两种互为同分异构体的产物,B是其中的一种,可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
试回答:
(1)写出符合下述条件,A的同分异构体的结构简式 (各任写一种):
a.具有酸性____________________,b.能发生水解反应______________________。
(2) C→D的反应类型是___________,E→F的反应类型是___________。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(3) D的结构简式是_____________。
(4)写出E生成高聚物的化学方程式:______________。
(5)两分子C脱去两分子水形成含有八元环的M,写出M的结构简式:______________________________。
现有A─E五种元素,其中C、D、E三种是短周期元素。A、B的单质均为生活中常见的金属,A的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160,B的相对原子质量比A大8。C是金属元素,其原子的M层有一个未成对的p电子;D元素的主族序数是其所在周期序数的3倍;E的某种原子的原子核内没有中子。
(1)请写出A在元素周期表中的位置__________________;写出C的核外电子排布式___________________;D和E按1:1的原子个数比形成的化合物中含有的化学键为______(填“极性键”、“非极性键”或“极性键和非极性键”)。
(2)①写出C单质与强碱溶液反应的离子方程式是_______________________。
②在高温条件下,将D、E组成的气态化合物与A 的粉末充分反应,生成8g E的单质和相应的固态化合物时,放出a kJ 热量,此反应的热化学方程式是 ________________________。
③A的某种氯化物溶液呈黄色,它与B的单质的反应工业上常用于腐蚀电路板,请写出反应的离子方程式________________________。