[化学——物质结构与性质]
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ.氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
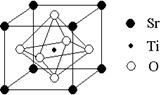
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。
Ⅱ.氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。
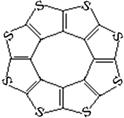
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| |
C—S |
C=S |
C16S8中碳硫键 |
| 键长/pm |
181 |
155 |
176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。
(4分)古希腊流传这样一个传奇故事:一批贩运纯碱的商船停泊在江边的沙岸部,商人们找不到石头来搭灶煮饭,就把船上的大块纯碱搬来,放在沙地上垫锅做饭,饭熟后商人们惊奇地发现“灶”变成了晶莹透明的固体。你认为这种固体可能是____________,其主要成分是________________________。
(8分)除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
(1)Fe(Al)____________(2)NH3(H2O)____________________-
(3)NO(NO2)____________ (4)NaCl溶液(Na2SO4)____________
有一质量为mg,相对分子质量为M的某种强碱M (OH)2,在一定温度下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为__________,溶质的质量分数为___________,此温度下该碱的溶解度为_________。
(1)将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为________,该混合气体的平均摩尔质量为___________。
(2)同温同压下,质量相同的五种气体:① CO2② H2③ O2④ CH4⑤ SO2
所占的体积由大到小的顺序是(填序号,下同)_________________;
所含原子数由多到少的顺序是__________________________;
密度由大到小的顺序是_________________________________。
(3)VmLAl2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中的SO42-的物质的量浓度是(单位为mol/L)______________
(4)标准状况下将224LHCl气体完全溶于1L水中,所得溶液的密度为1.1g/cm3,则所得稀盐酸的质量分数为____________, 物质的量浓度为_________________.
用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④转移、洗涤⑤定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是
(从下列中选用 A. 10ml B. 25ml C. 50ml D. 100ml)
(2)第③步实验的操作是
(3)第⑤步实验的操作是
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视溶液的液凹面