(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。

②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。

①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
(16分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):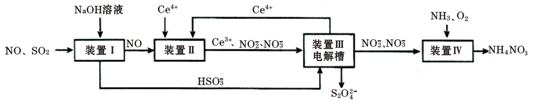
(1)装置Ⅰ中,NaOH溶液吸收SO2也可生成Na2SO3和NaHSO3的混合溶液
①写出NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时总反应的离子方程式。
②已知混合液pH随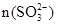 :n(
:n( )变化关系如下表:
)变化关系如下表:
 |
91:9 |
1:1 |
9:91 |
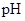 |
8.2 |
7.2 |
6.2 |
当混合液中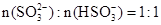 时,c(Na+)c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
时,c(Na+)c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
(2)装置Ⅱ中,酸性条件下,NO被Ce4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO2-的离子方程式;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成的Ce4+从电解槽的(填字母序号)口流出;
②生成S2O42 - 的电极反应式为;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NO3-,至少需向装置Ⅳ中通入标准状况下的O2L。(用含a代数式表示)
(13分) A、B、C、D、E、F、G、H是核电荷数依次增大的短周期主族元素。元素A的原子半径是所有元素中最小的。A、E同主族,B、C、D同周期,D、G最外层电子数相等,G的质量数为D的2倍,元素B的一种常见单质可做惰性电极材料,其最高价氧化物甲为常见温室气体。B、D、G的质子数之和等于F、H的质子数之和,I单质是日常生活中用量最大的金属,易被腐蚀或损坏。回答下列问题:
(1)I元素在周期表中的位置。
(2)化合物甲的结构式为。
(3)根据以上信息,下列说法不正确的是______________。
A.A和B能形成多种化合物
B.热稳定性: H2D< H2G
C.元素G的最高价氧化物对应水化物的酸性比H的弱
D.简单离子半径的大小顺序:rD <rE<rFE.沸点:H2D< H2G
F.同温同压下,将a L CA3和b L AH通入水中,若所得溶液的pH=7,则a>b
(4)常温下,相同浓度F、I简单离子的溶液中滴加NaOH溶液,F、I两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,I (OH)n完全沉淀的pH是2.8,则ksp较大的是:(填化学式)
(5)若在H与I组成的某种化合物的溶液乙中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极电极反应式为。
(6)若用石墨电极电解含有0.04 mol CuGD4和0.04 mol EH的混合溶液400 mL,当阳极产生的气体784 mL(标况)时,溶液的pH=(假设电解后溶液体积不变)。
(14分)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2 H2(g)+CO(g) CH3OH(g);
CH3OH(g);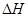 =-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下: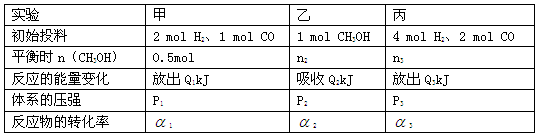
(1)该温度下此反应反应物的总键能和(填“大于”“等于”或“小于”)生成物的总键能和。
(2)在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则H2的平均反应速率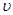 ( H2)为。
( H2)为。
(3)下列选项能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.容器内H2、CO、CH3OH的物质的量之比为2:1:1
B.容器内气体的密度保持恒定
C.容器内H2气体的体积分数保持恒定
D.2V正(H2)=V逆(CO)
(4)丙容器中,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
(填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡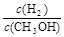 减小
减小
E.平衡常数K增大
(5)三个容器中的反应分别达平衡时各组数据关系正确的是(填序号)。
A.Q1+Q2=aB.α3<α1
C.P3<2P1=2P2D.n2<n3<1.0mol
(6)已知:①3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)△H=—247kJ·mol-l
CH3OCH3(g) +CO2(g)△H=—247kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H= -24 kJ·mol-l
CH3OCH3(g)+H2O(g)△H= -24 kJ·mol-l
③CO(g)+H2O(g) CO2(g)+H2(g)△H= -41 kJ·mol-l
CO2(g)+H2(g)△H= -41 kJ·mol-l
2 H2(g)+CO(g) CH3OH(g);
CH3OH(g);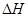 =-a KJ·mol-1,则a=
=-a KJ·mol-1,则a=
以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下: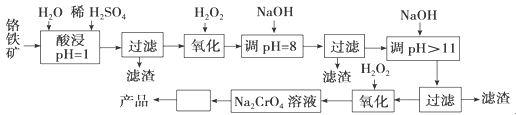
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下: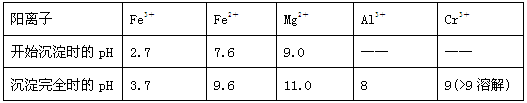
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:
__________________________________、____________________________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?请用必要的文字和离子方程式解释:_______________________________________________________。
(4)流程图中“□”内的操作是___________________、______________________、。
A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数相同,B位于元素周期表的S区。C元素原子的外围电子层排布式为nsn—1npn—1。D原子M能层为全充满状态,且最外层无成对电子,E的化合物种类最多。请回答下列问题:
(1)写出D基态原子的电子排布式;
(2)A的常见氢化物AH3的VSEPR模型为
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ,X是一种超硬物质,耐磨损、抗腐蚀能力强,
推测X的晶体类型为。
(4)E的最高价氧化物的结构式为中心原子的杂化方式为。
(5)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 。
(6)TiO2的天然晶体中,最稳定的一种晶体结构如下图,黑球表示原子。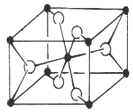
(7)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物,该化合物中Fe2+与环戊二烯基离子之间以(填“离子键”、“金属键”、“配位键”、“氢键”、“范德华力”)相结合。