降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题。
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)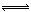 CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化如下表所示。
| |
P1 |
P2 |
P3 |
| T1 |
0.10 |
0.04 |
0.02 |
| T2 |
0.20 |
0.16 |
0.05 |
| T3 |
0.40 |
0.35 |
0.20 |
则Pl P3(填“>”“<”或“=”,下同)。若T1、Pl,T3、P3时平衡常数分别为K1、K3,则K1 K3。T1、Pl时H2的平衡转化率为 。
②一定条件下,t上述反应在密闭容器中达平衡。当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是____ 。
A.反应物的浓度降低
B.容器内压强增大
C.正反应速率大于逆反应速率
D.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释, (填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
a.c(K+)=2c(CO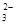 )+c(HCO
)+c(HCO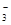 )+c(H2CO3)
)+c(H2CO3)
b.c(HCO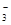 )
)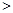 c(CO
c(CO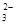 )
)
c.降低温度,c(H+)·c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为 。
26.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有。
(2)硫酸铜溶液可以加快氢气生成速率的原因是。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 混合液 |
A |
B |
C |
D |
E |
F |
| 4mol·L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=。
②反应一段时间后,实验E中的金属呈色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因。
25.发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g)ΔH =" +92.4" kJ·mol-1
N2 (g) + 3H2(g)ΔH =" +92.4" kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是。(填“高温”、“低温”或“任何条件下”)
(2) 已知:2H2(g)+O2(g)=2H2O(g)ΔH =" -" 483.6 kJ·mol-1
NH3(l) NH3(g)ΔH =" +23.4" kJ·mol-1
NH3(g)ΔH =" +23.4" kJ·mol-1
则,反应4NH3(l)+3O2(g)=2N2(g)+6H2O(g)的ΔH =。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3) ~ t的总趋势曲线(标注Ru-T2)
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是。
(已知:液氨中2NH3(l)  NH2- + NH4+)
NH2- + NH4+)
24.常温下有0.1 mol·L-1四种溶液NaOH、NH3·H2O、HCl 、CH3COOH
(1)已知CH3COOH溶液的pH=3,其电离度为,由水电离的c(H+)=mol·L-1。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线,a、b两点中,导电能力更强的是。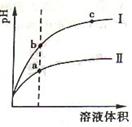
(3)NH3·H2O溶液和HCl溶液等体积混合后,溶液呈酸性的原因是(用离子方程式表示)。此时,该混合溶液中的微粒浓度关系正确的是。
| A.c(Cl-)>c(H+) >c(NH4+)>c(OH-) |
| B.c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| C.c(NH4+)+ c(NH3·H2O)= 0.1mol·L-1 |
| D.c(H+) = c(NH3·H2O)+c(OH-) |
(4)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)> V(HCl),当溶液中c(NH3·H2O)= c(NH4+)时,溶液的pH=,该混合液中加入少量的酸或碱,结果发现溶液的pH变化不大,其原因是。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
23.能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g) CH3OH(g) ΔH;
CH3OH(g) ΔH;
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①根据表中数据可判断ΔH0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为:,随着反应的不断进行溶液的pH(填“增大”“减小”或“不变”)。
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为mL(标况下)。
25.反应3NO2+H2O===2HNO3+NO中,氧化剂是________,氧化产物是________(填化学式)。
反应Mg+2HCl===MgCl2+H2↑中,氧化剂是________,氧化产物是________(填化学式).