(14分)工业上的常说“三酸两碱”是重要的化工原料。实验室桌面上的五个试剂瓶内(如下图)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”。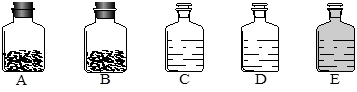
(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸。他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是 (填名称);②分别打开C、D瓶的瓶塞,观察到 ,说明C瓶内的是浓盐酸,D瓶内的是浓硫酸。
(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如下一个框图。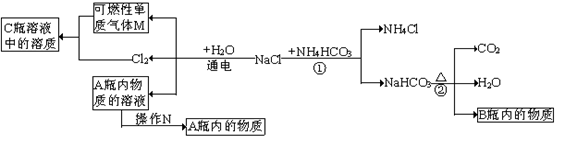
注:整个框图中每个化学反应涉及的物质已全部给出。
根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题。
Ⅰ.写出B瓶内物质的化学式 ,并写出②反应的化学方程式 。
Ⅱ.框图中的①反应所属的反应类型是 ,操作N的名称是 。
Ⅲ.请选用一种物理方法鉴别A、B瓶内的物质: ,
在实验室中能否通过滴加酚酞试液来区别A、B的溶液? (填“能”或“否”),为什么? 。
(3)在实际工业生产中得到的B物质中往往会含有少量的NaCl,现在一烧杯中盛有20.4gB物质和NaCl 组成的固体混合物。向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题: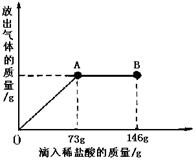
①当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填>、=、<)。
②当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)(4分)
学习碱的个性时,同学们在实验室中做“检测氢氧化钙性质 ”的实验,实验方案如图所示(说明:实验中使用的药品均是溶液)。
请回答下列问题:
(1)写出盐酸加入氢氧化钙中反应的化学方程式:;在实验过程中 ,并没有观察到该反应的明显现象 ,请你写出一种能观察到变化发生的方法:。
(2)实验结束后,同学们将四支试管中的物质全部倒入废液缸中,为了处理废液渣,首先对废液缸中物质的成分进行初步分析,过程如下图所示:
由上述分析可知:
①固体A中一定还有碳酸钙和。
②无色溶液 B中使酚酞试液变红的物质是。
A~J分别为九年级化学学过的不同物质,它们存在右下图所示的转化关系。已知A为铁锈的主要成分,E在常温下为液体,H的溶液呈蓝色,常温下B、D、F均为无色气体,其中J不稳定,受热易分解。(反应②、④的个别生成物已略去)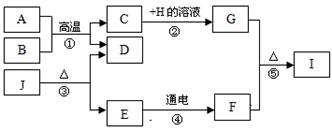
(1)写出化学式:J;F。
(2)写出反应①的化学方程式:。
(3)写出反应⑤的化学方程式:。
已知A、B、C、D、E、F是初中化学中常见的六种物质,它们之间在一定条件下有如图所示的转化关系(图中“→”表示物质间存在转化关系,“”表示两种物质间能发生反应)。又知A、B、D都是由两种元素组成,且A、B所含元素各不相同;C、E均含三种元素,其中E常用来改良酸性土壤;F是一种能维持生命活动的单质(通常状态下为气体)。请按要求回答下列问题:
(1)写出F的名称,E的俗名;A的化学式;
(2)写出下列反应的化学方程式:
①B+D:;
②写出一种能生成C,且反应物为两种盐的复分解反应:。
(8分)甲、乙、丙、丁、戊分别是稀硫酸、镁、氢氧化钠溶液、氧化镁及硫酸铜溶液中的一种。下图反映了它们之间的相互关系。其中“一”表示相连的物质间可以相互反应,“→”表示甲在一定条件下可以转化为戊。已知丁溶液呈蓝色。请回答以下问题:
(1)写出下列物质(或溶质)的化学式:
甲 、戊。
(2)图中各反应不含有四种基本反应类型中的反应。
(3)写出下列反应的化学方程式:
乙与丙:。
丙与丁:。
(4)例举丙在生产、生活中的一种用途:。
(5分)金属元素在生活、生产中,以及对人类的健康有着很重要的作用.用金属铁制备自来水的新型消毒、净水剂K2FeO4的流程如图
请回答下列问题:
(1)固体B的成分是______________,反应a的化学方程式为:____________________.
(2)操作I的名称是_____________;操作I所需要的仪器和用品:铁架台、玻璃仪器、试剂、_______(填一种实验物品名称).
(3)反应a、b、c中没有涉及到的化学反应类型是___________(填字母代号).
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应. |