草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
【提出假设】假设1: 该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】
(1)称取 g草酸晶体(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪[色时间[(s) |
|||
| 0.10 mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50 mol/L 稀硫酸 |
|||
| 1 |
30 |
20 |
30 |
20 |
|
18 |
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65 ℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5 mL 0.10 mol/L K2SO4溶液 |
18 |
则x = ,假设2成立
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10 mol/L H2C2O4溶液于锥形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。上述实验中KMnO4溶液的物质的量浓度为 。
某同学查阅资料后设计了一条1-丁醇的合成路线:CH3CH===CH2+CO+H2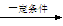 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH。其中CO的制备方法:HCOOH
CH3CH2CH2CH2OH。其中CO的制备方法:HCOOH CO↑+H2O。
CO↑+H2O。
请填写下列空白:
(1)利用以上装置制备CO、丙烯等原料气体,装置中a的作用__________;b的作用_________。
(2)制丙烯时,伴随的副反应还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4⑤品红溶液
(3)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
| A.高温、常压、催化剂 |
| B.适当的温度、常压、催化剂 |
| C.低温、高压、催化剂 |
| D.适当的温度、高压、催化剂 |
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
试剂1为________,操作2为________,操作3为________。
某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇(含18O)、无水醋酸钠,D中放有含有酚酞饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H5OH ; ②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用是;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:。
(2)球形干燥管C的作用是。反应结束后D中的现象是。
(3)上述实验中饱和碳酸钠溶液的作用是。
(4)欲从D中得到乙酸乙酯的分离方法是;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;
(5)某化学课外小组设计了如图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有:(请写出两点)
,。 
(共14分)某同学设计如下实验装置探究硫酸与金属、非金属的反应、验证其产物,并探究随着反应的进行,硫酸性质发生的变化。根据实验要求回答相关问题:
F装置用于检验二氧化碳。供选择的试剂有:只含碳的生铁、18 mol·L-1的硫酸、品红溶液、无水硫酸铜粉未、酸性高锰酸钾溶液、氧化铜、澄清的石灰水、碱石灰。(供选择的试剂可重复使用)
(1)打开分液漏斗的活塞,A装置中发生的反应6H2SO4(浓)+2Fe Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示),随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)。
Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示),随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)。
(2)B装置中的试剂是。
(3)E装置中的作用是。
(4)G装置中的试剂是,现象是。
(5)从安全角度考虑,应后点燃的酒精灯(填“A”或“G”)。你认为本实验尾气是否需要处理?(填“是”或“否”),如需处理,具体方案是。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,原因是。
(2)哪一段时段的反应速率最小,原因是。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程)。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:你认为可行的是(填编号) 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步骤如下: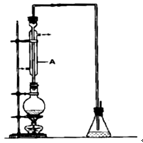
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、溴化钠、浓硫酸及几粒碎瓷片;
③小心加热,使其充分反应。
请问答下列问题。
(1)装置A的作用是。
(2)反应结束后,得到的粗产品呈棕黄色(含少量的溴单质)。为了除去粗产品中的杂质,可选择下列试剂中的(填写上正确选项的字母)。
a.亚硫酸钠溶液b.氢氧化钠溶液
c.乙醇d.四氯化碳
该实验操作中所需的主要玻璃仪器是(填仪器名称)。
(3)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水 ,然后进行的实验操作是(填写正确选项的字母)。
,然后进行的实验操作是(填写正确选项的字母)。
a.分液b.蒸馏 c.萃取
(4)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后(按实验的操作顺序选填下列序号)。
①加热 ②加入 溶液③加入稀
溶液③加入稀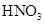 酸化④加入NaOH溶液
酸化④加入NaOH溶液