铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计的原电池,请在图甲中的横线上完成标注。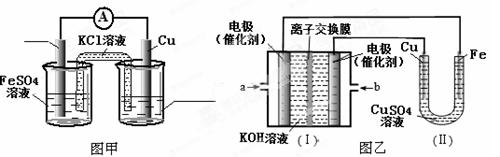
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ;
若把II中电极均换为惰性电极,电解液换为含有0.1 mol NaCl溶液400 mL,当阳极产生的气体为448 mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后, 直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
⑴D的化学式为▲;F的电子式为▲。
⑵A与B生成D的反应在工业上是生产▲的反应原理之一。
⑶E与G的稀溶液反应的离子方程式为▲。
⑷B和C反应的化学方程式为▲。
⑸J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式▲。
PTT是近几年来迅速发展起来的新型热塑性聚酯材料,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
⑴A中所含官能团的名称为▲,B的结构简式为▲。
⑵由物质C与D反应生成PTT的化学方程式为▲,反应类型为▲。
⑶分子式为C4H6O、与A互为同系物的同分异构体有▲种。
⑷请补充完整下列以CH2=CHCH3为主要原料(无机试剂任用)制备CH3CH(OH)COOH的合成路线流程图(须注明反应条件)。
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为: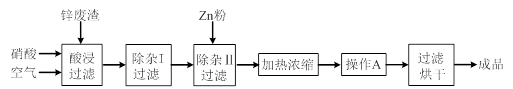
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.0 |
⑴在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 ▲。
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 ▲。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为 ▲。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ▲。检验Fe3+是否沉淀完全的实验操作是 ▲。
⑷加入Zn粉的作用是 ▲。“操作A”的名称是 ▲。
(共14分)
Ⅰ.下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:2的是()
Ⅱ.PCT是一种新型聚酯材料,下图是某研究小组合成PCT的路线。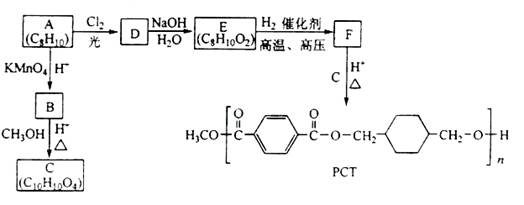
请回答下列问题:
(1)由A生成D的化学方程式为________________________________________;
(2)由B生成C的反应类型是________________;
(3)由E生成F的化学方程式为____________,该反应的类型为__________________;
(4)D的同分异构体中苯环上只有一个取代基的芳香化合物有_______________(写结构简式)
(5)B的同分异构体中,能发生水解反应,且苯环上一氯代产物只有一种的是________________(写结构简式)。
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的化合物。
已知:
①反应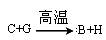 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
② I是一种常见的温室气体,它和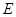 可以发生反应:2E+I
可以发生反应:2E+I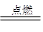 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________________;
(2)化合物Ⅰ的电子式为______________________;
(3)C与过量NaOH溶液反应的离子方程式为___________________________;
(4)推测E在I中燃烧可能观察到的现象是__________________________。