设NA为阿伏加德罗常数,则下列说法正确的是
| A.一定条件下,2.3g Na完全与O2反应生成3.6g产物时得到的电子数为0.1NA |
| B.1L 0.1mol醋酸溶液中所含分子数少于0.1NA |
| C.水分子中1mol羟基含有的电子总数为9NA |
| D.1 mol H2O2含有极性共价键键数为NA,含有非极性共价键为键数2NA |
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是
| A.减小压强能增大反应速率 | B.增大压强能减小反应速率 |
| C.使用适当的催化剂能增大反应速率 | D.升高温度对反应速率无影响 |
已知下列元素的原子半径:
| 元素 |
N |
S |
O |
Si |
| 原子半径/10-10m |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷元素的原子半径可能是
A.0.80×10-10 m B.1.10×10-10 m C.1.20×10-10 m D.0.70×10-10 m
下列各组物质中,互称为同分异构体的是
| A.水与冰 | B.O2与O3 |
C. |
D.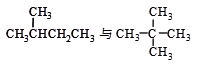 |
下面关于化学反应的限度的叙述中,正确的是
| A.化学反应的限度都相同 |
| B.可以通过改变温度控制化学反应的限度 |
| C.可以通过延长化学反应的时间改变化学反应的限度 |
| D.当一个化学反应在一定条件下达到限度时,反应即停止 |
在常温常压下,下列四种气态烃各1mol分别在足量氧气中燃烧,消耗氧气最多的是
| A.CH4 | B.C2H6 | C.C3H8 | D.C4H10 |