“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g)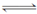 H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g)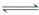 CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g)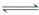 C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图: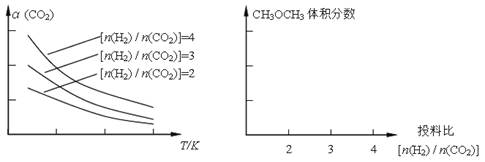
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是 。
| A.P3>P2,T3>T2 | B.P1>P3,T1>T3 |
| C.P2>P4,T4>T2 | D.P1>P4,T2>T3 |
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)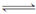 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为 。
(15分)有机物G是一种食品香料,其香气强度为普通香料的3~4倍,有机物I的合成路线如下:
已知:
⑴该香料长期暴露于空气中易变质,其原因是。
⑵写出A中含氧官能团的名称:,由C到 D的反应类型为。
⑶有机物E的结构简式为。
⑷有机物G同时满足下列条件的同分异构体有种。
①与FeCl3溶液反应显紫色;
②可发生水解反应,其中一种水解产物能发生银镜反应;
③分子中有4种不同化学环境的氢。
⑸写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
(12分)酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下: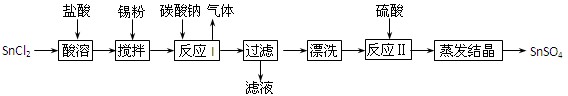
回答下列问题:
⑴SnCl2用盐酸而不用水直接溶解的原因是,加入Sn粉的作用是。
⑵反应I生成的沉淀为SnO,写出该反应的化学方程式:。
⑶检验沉淀已经“漂洗”干净的方法:。
⑷反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L—1,则应控制溶液pH。已知:Ksp[Sn(OH)2]=1.0×10—26。
⑸酸性条件下,SnSO4还可以用作双氧水去除剂,试写出发生反应的离子方程式:
。
茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 _________________________________________ ;
(2)写出检验Ca2+的离子方程式 ___________________________;
(3)写出沉淀C所含主要物质的化学式 _____________________________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式_____________________________;
(5)步骤⑨的作用是;
(6)猜测步骤⑩的目的是 _________________________________ ;
(7)已知:2Fe (s)+ 3/2O2 (g)= Fe2O3(s),△H = — Q1kJ·mol-1
2Al(s) + 3/2O2 (g)= Al 2O3(s),△H = — Q2kJ·mol-1
则Q1 ___________Q2(填“>”,“<”或“=”)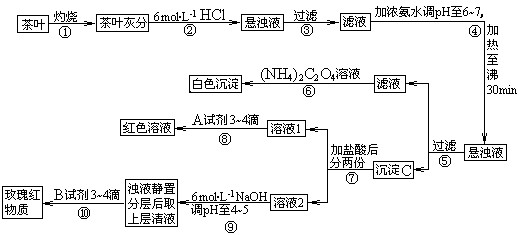
氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥体,沸点-129 ℃;可在铜催化作用下由F2和过量NH3反应得到。
NF3属于 晶体,写出制备 NF3的化学反应方程式: 。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①与N3-互为等电子体的分子、离子有: 、 (各举1例),由此可推知N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co (N3)(NH3)5]SO4、
Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。
[Co (N3)(NH3)5]SO4中钴的配位数为 ,CN—中C原子的杂化类型是 。
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体可溶于水,则该异构体是(填“极性”、“非极性”)分子。
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是(选填序号)
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
____________。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。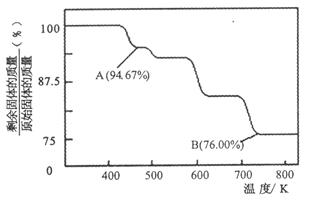
①A 点时剩余固体的成分是_________(填化学式)。
②从开始加热到 750K 时总反应方程式为_______________________。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为mol·L-1。