在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
| 实验编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
|
| n(X) |
n(Y) |
n(M) |
||
| ① |
700 |
0.40 |
0.10 |
0.090 |
| ② |
800 |
0.10 |
0.40 |
0.080 |
| ③ |
800 |
0.20 |
0.30 |
a |
| ④ |
900 |
0.10 |
0.15 |
b |
回答下列问题:
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为_ 。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A.c(Y)= c(N) B.平均分子量不再变化
C.v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_____________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A.a>2b B.a=2b C.b<a<2b D.a<b
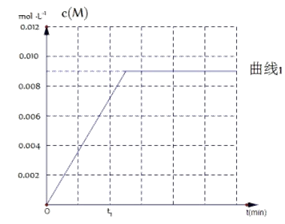
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。
[化学——选修3:物质结构与性质](15分)前四周期原子序数依次增大的元素A、B、C、D中A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
(1)D2+的价层电子排布图为。
(2)四种元素中第一电离能最小的是,电负性最大的是。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。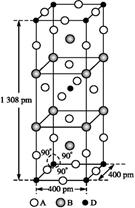
①该化合物的化学式为,D的配位数为;
②列式计算该晶体的密度g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有;
(5)该化合物中存在一个复杂离子,该离子的化学式为,配位体是。
[化学——选修2:化学与技术](15分)草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下: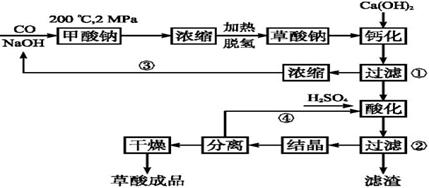
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为、。
(2)该制备工艺中有两次过滤操作,过滤操作②的滤液是和,滤渣是。
(3)工艺过程中③和④的目的是。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是____________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250 g溶于水,用0.050 0 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为;列式计算该成品的纯度。
(1)25℃时,在0.10mol/L的氨水中逐滴加入同浓度的盐酸(不计两者的挥发性),回答下列问题:
①当溶液pH=7时,溶液中c(NH4+)c(Cl-)(用“<”、“>”、“=”填空,下同);
②当盐酸和氨水溶液恰好中和时,溶液中c(H+)c(OH-);
(2)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。某实验小组的同学对该厂生产的印刷电路后所得的废液进行了分析:取50mL废液,向其中加入足量的稀硝酸,生成0.02molNO;另取50mL废液,向其中加入足量的AgNO3溶液,析出沉淀43.05g。
请回答以下问题:
①该厂原来使用的FeCl3溶液中溶质的物质的量浓度为_____(反应前后溶液的体积变化忽略不计);
②废液中各金属阳离子的物质的量浓度之比为C(Fe3+):C(Fe2+):C(Cu2+)=__________;
③另取50mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围是。
X、Y、Z、W、V是原子序数依次增大的短周期主族元素,其中两种为金属元素。Y的原子半径是短周期主族元素中最大的,Z的单质可与Y的最高价氧化物的水化物溶液反应,X与W同主族,且W的原子序数是X的两倍。请回答下列问题:
(1)W的氢化物的电子式是,其相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,可能的原因是_________________________;
(2)Z的单质与Y的最高价氧化物的水化物溶液溶液反应的离子方程式是______________;
(3)X与W以原子个数比2∶1形成的化合物能使溴的水溶液褪色,写出反应的离子方程式__________,该化合物表现了性;
(4)V的单质溶于水后形成的溶液中存在的粒子有种。
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。全钒液流电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子【V2+(紫色)、V3+(绿色)、VO2+(蓝色)、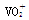 (黄色)】为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O
(黄色)】为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O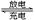 V2++
V2++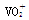 +2H+。如图1是钒电池基本工作原理示意图:
+2H+。如图1是钒电池基本工作原理示意图: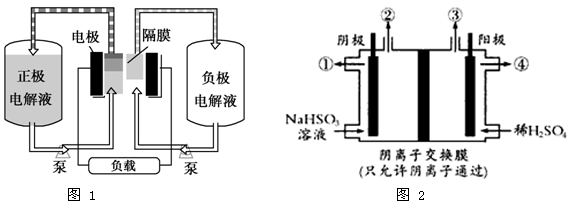
请回答下列问题:
(1)放电时的正极反应式为_________________________;
(2)充电时的阴极反应式为________________,充电过程中,电解液的pH(选填“升高”“降低”或“不变”)。
(3) 放电过程中氢离子的作用是____________________________;若充电时转移电子的数目为6.02×1023,则左槽溶液中H+的变化量为mol 。
(4) 以全钒液流电池为电源,用惰性电极电解NaHSO3溶液可制得硫酸,装置如图2所示。阴极的电极反应式为。
(5)电解过程中③处的生成物是(填化学式)。