碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g) ΔH2=" -565" kJ·mol-1
2CO2 (g) ΔH2=" -565" kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
③一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。
温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是 
(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为
②方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是,用文字和化学用语解释原因 。
从①Ba(OH)2 ②HCl ③Zn ④CuSO4 ⑤CaCO3中选出合适的物质,实现下列各题要求的变化,写出化学反应的化学方程式,是离子反应的写出离子方程式。
(1)实验室制取CO2的反应
(2)实验室制取H2的反应
(3)生成沉淀的反应
(4)盐与金属的置换反应
(5)酸碱之间的中和反应
现有以下物质:①NaCl晶体, ②液态HCl, ③ CaCO3固体, ④熔融KCl, ⑤蔗糖, ⑥铜, ⑦CO2,⑧浓H2SO4,⑨KOH固体。以上物质中属于电解质的是,属于非电解质的是,在该状态下能导电的是。
下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 原子半径 |
0.102 |
0.075 |
0.117 |
0.074 |
0.110 |
0.071 |
0.099 |
0.077 |
| 最高化合价 |
+6 |
+5 |
+4 |
+5 |
+7 |
+4 |
||
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:①A与D可形成化合物AD2、AD3,②B与D可形成多种化合物,其中BD、BD2是常见的化合物,C可用于制光电池。请回答:
(1)E在周期表中位置是:
(2)C和H的气态氢化物的稳定性强弱关系为:(用分子式表示)
(3)32g AD2气体和D2气体恰好完全反应生成AD3气体,放出49.15kJ的热量,则其反应热化学方程式为:
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:。
(5)工业上可用纯碱溶液处理BD和BD2,该反应如下:
BD+BD2+Na2CO3=2 +CO2横线上某盐的化学式应为
A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D。D和A形成简单离子后,它们电子层相差两层。已知A处于第n族,D处第m族,且A单质中只含共价健。B的气态氢化物的分子式为H2B,在其最高氧化物中B的质量分数为40%,B原子核内质子数和中子数相等。C与A可形成CA3型化合物,C与A、B在同一周期,B与A左右相邻。试回答:
(1).若n-m=6,则A与D形成化合物电子式为;
(2).D的原子序数为;(用含m代数式表示)
(3).A和B的简单离子半径大小关系;(用离子符号表示)
(4).向A、C形成的化合物中滴入氨水,其反应的离子方程式为。
已知X、Y、Z、W、M五种元素,X、Z、W在元素周期表位置如下周期表,
① ZX4+ + WX- ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
分子中质子数相等。回答下列问题: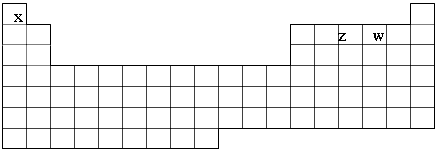
(1).在周期表中写出M,Y的元素符号;
(2).写出ZX3的化学键类型: ;
(3).写出M单质与NaOH溶液反应的离子方程式 ;
(4).M的最高价氧化物对应水化物与Z的最高价氧化物对应的水化物反应的化学方程式为: 。