某温度下,CO(g) + H2O (g) 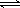 CO2(g) + H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
CO2(g) + H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
| |
甲 |
乙 |
||
| |
起始浓度 |
5min时浓度 |
起始浓度 |
5min时浓度 |
| c(CO)/mol/L |
0.1 |
0.08 |
0.2 |
x |
| c(H2O)/mol/L |
0.1 |
0.08 |
0.2 |
y |
下列判断不正确的是
A.x =" y" = 0.16
B.反应开始时,乙中反应速率比甲快
C.甲中0~5min的平均反应速率: v(CO)="0.004" mol/(L·min)
D.平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
图中,两电极上发生的电极反应为:a极:Cu2++2e—=Cu,b极:Fe—2e一=Fe2+,下列说法中不正确的是()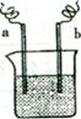
| A.该装置可能是电解池 |
| B.a极上发生的是还原反应 |
| C.a、b不可能是同种电极材料 |
| D.该装置工作时,溶液中的阴离子向b极移动 |
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( )
| A.阳极发生还原反应,其电极反应式:Ni2++2e-= Ni |
| B.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| C.电解过程中,阳极质量的减少与阴极质量的增加不相等 |
| D.电解后,电解槽底部的阳极泥中只有Pt |
已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH +2H2O  Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是()
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是()
| A.充电过程是化学能转化为电能的过程 |
| B.充电时阳极反应:Ni(OH)2-e- + OH-=" NiOOH" + H2O |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是()
①增大压强;②增加炭的量;③通入CO2;④恒压下充入N2;⑤恒容下充入N2;⑥升温
①③④ B.②④⑥ C.①③⑥D.③⑤⑥
将等质量的两份足量的锌粉a、b分别加入到等量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是()