碳氧化物的转化有重大用途,回答关于CO和CO2的问题。
(1)己知:①C (s) + H2O(g) CO (g) +H2 (g) △H1
CO (g) +H2 (g) △H1
②2CO(g) + O2(g) = 2CO2 (g) △H2
③H2O (g)= H2 (g) +1/2 O2 (g) △H3
则C (s) + O2 (g) =CO2 (g)的△H = (用△H1、△H2、△H3表示)。
(2)对于化学平衡①,在不同温度下,CO的浓度与反应时间的关系如图所示,

由图可得出如下规律:随着温度升高,① ;② 。
(3)某温度下,将6.0 mol H2O(g)和足量碳充入3 L的恒容密闭容器中,发生如下反应:C(s) + H2O(g) CO(g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
CO(g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
(4)在神州九号飞船中,宇航员呼出的CO2也可以采用Na2O2吸收,写出相关的化学方程式并标明电子转移的方向和数目: 。
(1)在S+2KNO3+3C=K2S+N2+3CO2的反应中元素被氧化,元素被还原;
是氧化剂,是还原剂;是氧化产物,是还原产物。
(2)某物质A在一定条件下加热分解,产物都是气体,分解方程式为:
2A(s)=" B(g)" + 2C(g) + 2D(g),取一定量的A加热,完全分解,同温同压下测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为。
(3)现有A、B、C、D四瓶溶液,它们分别是NaCl(0.1mol?L-1)、HCl(0.1mol?L-1)、NaOH(0.1mol?L-1)和酚酞试液(0.1%)中的一种。有人不用其他试剂,就可以把它们一一鉴别开来,其实验步骤如下:
①各取溶液少许两两混合,据现象不同分成两组;
②取一组混合液,不断滴入另一组的一种未知溶液,根据现象不同可鉴别出A和B两种溶液;
③再取已鉴别出A溶液2mL, 滴入3滴未知C溶液,再加入D溶液4mL,在这个过程中无明显颜色变化;
综合以上实验可知,A、B、C、D溶液分别是:
A; B; C; D。
常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是:
(2)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法:
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(结合化学方程式说明):
(4)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有人设计如下图所示的装置:
请简述实验操作及原理:
威斯迈尔反应是在富电子芳环上引入甲酰基的有效方法。其过程首先是N,N-二甲基甲酰胺与POCl3反应生成威斯迈尔试剂:
接着威斯迈尔试剂与富电子芳环反应,经水解后在芳环上引入甲酰基。例如: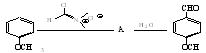
10-1用共振式表示威斯迈尔试剂正离子。
10-2由甲氧基苯转化为对甲氧基苯甲醛的过程中,需经历以下步骤:⑴芳香亲电取代⑵分子内亲核取代⑶亲核加成⑷质子转移⑸消除。画出所有中间体的结构简式。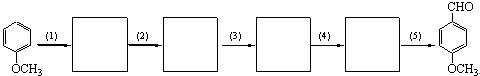
10-3完成下列反应: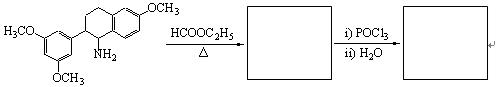
化合物A、B和C的分子式均为C7H8O2。它们分别在催化剂作用和一定反应条件下加足量的氢,均生成化合物D(C7H12O2)。D在NaOH溶液中加热反应后在酸化生成E(C6H10O2)和F(CH4O)。
A能发生如下转化: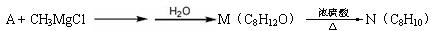
生成物N分子中只有3种不同化学环境的氢,它们的数目比为1∶1∶3。
9-1 画出化合物A、B、C、D、E、M和N的结构简式。
9-2 A、B和C互为哪种异构体?(在正确选项的标号前打钩)
①碳架异构体②位置异构体③官能团异构体④顺反异构体
9-3 A能自发转化为B和C,为什么?
9-4 B和C在室温下反应可得到一组旋光异构体L,每个旋光异构体中有个不对称碳原子。
化合物B是以β-紫罗兰酮为起始原料制备维生素A的中间体。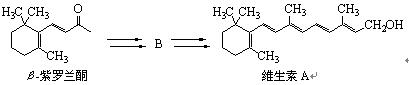
由β-紫罗兰酮生成B的过程如下所示: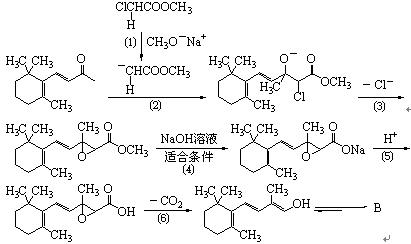
8-1 维生素A分子的不饱和度为。
8-2 芳香化合物C是β-紫罗兰酮的同分异构体,C经催化氢解生成芳香化合物D,D的1H NMR图谱中只有一个单峰。画出C的结构简式。
8-3 画出中间体B的结构简式。
8-4 以上由β-紫罗兰酮合成中间体B的过程中,⑵、⑶、⑷、⑹步反应分别属于什么反应类型(反应类型表述须具体,例如取代反应必须指明是亲电取代、亲核取代还是自由基取代)。