(13分)Cr2O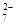 和CN-是工业废水中常见的污染物.若利用下列流程可对分别含两种离子的废水进行综合处理:
和CN-是工业废水中常见的污染物.若利用下列流程可对分别含两种离子的废水进行综合处理: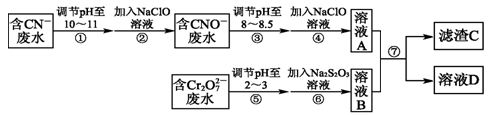
已知:Cr3+也有一定毒性,Cr3+在pH=6.0时开始沉淀,pH=8.0时沉淀完全.
回答下列问题:
(1)已知步骤②中无气体生成,写出反应的离子方程式______________________.
步骤④中NaClO可将CNO-处理为完全无害的溶液,该过程中有两种无毒的不支持燃烧的气体产生,写出这两种气体的化学式____________________________.
(2)步骤⑥的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每处理1 mol Cr2O72-转移________mol电子.
(3)滤渣C的化学式为Cr(OH)3,溶液A和溶液B混合可使废水中的Cr3+沉淀的原因是______________________________________________________.
(4)步骤⑦的操作名称为___________,若该操作在实验室中进行,则所需的玻璃仪器为________.
某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行: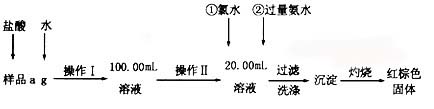
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、(填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为;
(3)若不用氯水,可用下列试剂中的代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是。
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为
(请把结果约到最简)。
(16分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。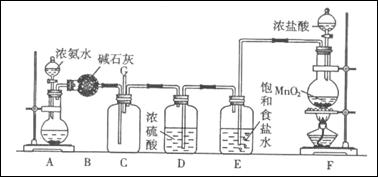
请回答下列问题:
(1)装置F中发生反应的离子方程式为。
(2)装置A的烧瓶中可装试剂为。
(3)B装置的名称是; E装置的作用是。
(4)通入C装置的两根导管左边较长、右边较短,目的是。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(a、b的代数式表示)。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2。为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。
(1)若在烧瓶中放入0.65 g锌粒,与c mol·L-1的H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是。
A.200 mLB.300 mLC.400 mL
(2)若0.65g锌粒完全溶解,装置Ⅲ 增重0.64 g,则圆底烧瓶中发生反应的化学方程式为;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体,则有:a g÷65 g·mol-1×2=b g÷64 g·mol-1×2+V mL÷22400 mL·mol-1×2,该等式依据的原理是;
(4)若在烧瓶中投入10g锌,加入一定量的18 mol·L-1浓硫酸10 mL,充分反应后锌有剩余,测得装置Ⅲ 增重3.2 g,则整个实验过程产生的气体中,m(SO2)/m(H2)=;若撤走装置Ⅱ中盛有无水氯化钙的U形管,m(SO2) / m(H2)的数值将(填“偏大”、“偏小”或“无影响”)。
科学探究
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究。请按要求填写。
(1)观察不同时间试管内的H2和O2体积的比值均约为。
(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成H2、O2的质量,计算过程如下:
并填表如下:
| 质量g |
物质的量mol |
H2和O2物质的量的比 |
|
| H2 |
|||
| O2 |
根据该实验的观察与推算初步得到关于气体体积规律的一个结论是:在相同的温度和压强下,
(3)下表列出了一些物质的体积
| 条件 |
物质 |
1 mol物质的体积 |
| 0℃101kPa |
H2 |
22.3 L |
| O2 |
22.4 L |
|
| CO2 |
22.4 L |
|
| 25℃101kPa |
H2 |
24.4L |
| O2 |
24.5L |
|
| CO2 |
24.5L |
根据上表数据,得出的结论是(至少写出三点)
①在相同的温度压强下,
②
③
④
(4)请从微观的角度解释气体体积变化规律的原因:
实验题
下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制200 mL 1.0 mol/L的稀硫酸。可供选用的仪器有:
①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制上述稀硫酸时,还缺少的仪器有________________________(写仪器名称);
(2)标签所示浓硫酸的物质的量浓度为___________________________
(3)配制200 mL 1.0 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL(计算结果保留小数点后1位),量取硫酸时应选用_______规格的量筒;
| A.10 mL | B.50 mL |
| C.100 mL | D.200 mL |
(4)根据计算结果,进行如下实验操作:
①用量筒取计算所需体积的浓硫酸;
②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;
③立即将稀释后的溶液转入容量瓶中;
④然后将蒸馏水沿玻璃棒注入容量瓶直至刻度线;
⑤把容量瓶盖盖紧,上下颠倒摇匀。
你认为上述实验中错误的操作是______________________________(填序号)
(5)经过测定,某同学配制的稀硫酸浓度偏高,则可能的原因是_______(填序号)
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁后将洗涤液弃去
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容、摇匀后发现溶液的凹液面低于刻度线