海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
| A.从海水中可得到NaCl,电解熔融NaCl或其水溶液都可制得Cl2 |
| B.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| C.利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 |
| D.无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 |
将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为(稀溶液中体积变化忽略不计)( )
| A.9 | B.10 | C.11 | D.12 |
下列说法正确的是()
| A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
| D.NCl3分子中所有的原子均为8电子稳定结构 |
在某些化学知识用数轴表示能体现出直观形象、简明易记的特点。下列用数轴表示正确的是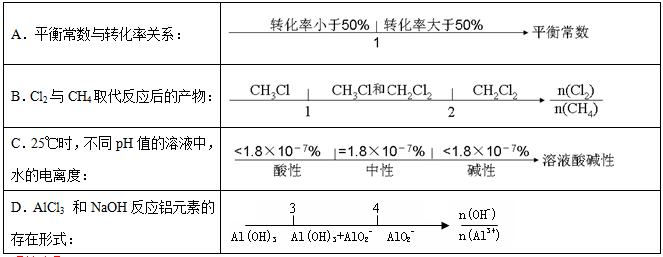
温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/ mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是
| A.实验过程中水的电离程度的变化是先减小后增大 |
| B.当溶液呈中性时,反应恰好完全 |
| C.当反应恰好完全时,消耗NaOH溶液10mL |
| D.当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+) |